
- •Министерство сельского хозяйства Российской Федерации
- •Введение.
- •Лекция 1 механика
- •1.1 Предмет физики.
- •1.2. Основные математические понятия
- •Приращение функции – изменение функции.
- •Основные свойства производной:
- •Градиент функции.
- •Международная система единиц «си»
- •1.3. Основы теории погрешности
- •1.4. Кинематика. Основные параметры простейших видов движения
- •Параметры вращательного движения:
- •Характеристики колебательного движения
- •1.5.Основные динамические характеристики
- •Физическая природа сил.
- •1.6.Основные законы динамики.
- •Закон сохранения импульса
- •Закон изменения импульса
- •Работа. Мощность. Энергия.
- •Закон сохранения энергии (для изолированной системы).
- •Полная энергия гармонических колебаний.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Лекция 2 гидростатика. Гидродинамика
- •1.1.Основные законы гидростатики
- •1.2. Основные понятия и законы гидродинамики.
- •Закон Ньютона для внутреннего трения.
- •Закон Стокса.
- •Закон Пуазейля.
- •Принцип аэрации почвы.
- •1.3. Свойства жидкости.
- •Поверхностное натяжение.
- •Поверхностно активные вещества
- •1.4. Жидкость в капиллярах.
- •Вопросы для самоконтроля
- •Список литературы
- •Основные уравнения мкт.
- •Основные процессы и понятия.
- •Экспериментальные газовые законы.
- •Понятие идеального газа
- •Изотермы Ван-дер-Ваальса.
- •1.4.Диффузия
- •1.5.Теплопроводность
- •1.6.Внутреннее трение
- •Уравнение Ньютона.
- •1.7.Уравнение переноса в общем виде.
- •Лекция 4 термодинамика
- •1.1.Понятие числа степеней свободы
- •1.2.Основные понятия термодинамики
- •Уравнение Майера
- •Показатель адиабаты
- •1.3.Основные законы термодинамики
- •1.4.Работа при термодинамических процессах.
- •Работа при изотермическом процессе.
- •Работа при изобарическом процессе.
- •Работа при адиабатическом процессе.
- •1.5.Тепловая машина. Цикл Карно.
- •Свойства энтропии.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Лекция 5
- •Теорема Остроградского – Гаусса.
- •Принцип суперпозиции.
- •1.2.Работа электрического поля. Потенциал электрического поля.
- •Связь напряженности и потенциала.
- •Теорема Ирншоу.
- •1.3.Проводники и диэлектрики в электрическом поле.
- •Диэлектрики в электрическом поле.
- •1.4.Электрическая емкость. Конденсатор.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 6 электрический ток
- •1.1.Понятие электрического тока и условия его существования.
- •1.2.Параметры электрического тока.
- •1.3.Основные законы
- •Электрический ток в электролитах
- •Зависимость сопротивления электролитов от температуры.
- •1.5..Электрический ток в полупроводниках. Полупроводниковые приборы.
- •Полупроводниковый диод p-n переход.
- •Полупроводниковый триод
- •1.6.Электрический ток в газах.
- •Вольт-амперная характеристика газового разряда.
- •1.7. Термоэлектронная эмиссия. Электровакуумные приборы.
- •Полупроводниковый триод.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 7 Магнетизм и электромагнетизм
- •1.1.Параметры магнитного поля.
- •1.2.Основные формулы и законы.
- •Закон Ампера.
- •1.3. Действие магнитного поля на проводник с током.
- •1.4 Виды магнетиков. Гистерезис.
- •1.5. Явление электромагнитной индукции. Закон Фарадея.
- •Закон Фарадея.
- •Правило Ленца.
- •1.6.Получение переменного тока
- •1.7.Явление взаимной индукции и самоиндукции.
- •Резистор в цепи переменного тока:
- •Конденсатор в цепи переменного тока:
- •Сопротивление конденсатора в цепи переменного тока.
- •Катушка индуктивности в цепи переменного тока.
- •Зависимость индуктивного и емкостного сопротивления от частоты тока.
- •Обобщенный закон Ома
- •1.9.Резонанс в цепи переменного тока.
- •1.10.Колебательный контур
- •1.11.Электромагнитные волны
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 8 Оптика
- •1.1. Природа света.
- •1.2.Геометрическая оптика.
- •Закон отражения.
- •1.3.Элементы волновой оптики Дисперсия
- •Интерференция.
- •Дифракция.
- •Условия интерференционного максимума и минимума.
- •Поляризация.
- •Основные фотометрические характеристики.
- •1.4.Фотоэффект и законы внешнего фотоэффекта
- •1.5.Люминесценция
- •Правило Стокса.
- •1.6.Световое давление
- •1.7. Излучение и поглощение света веществом.
- •1.8.Законы излучения абсолютно черного тела.
- •Вопросы для самоконтроля
- •Список литературы
- •1.2.Виды радиоактивного излучения
- •1.3.Энергия связи. Дефект массы атомного ядра.
- •1.4.Виды ядерных реакций
- •Применение ядерной энергии.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Содержание
Основные уравнения мкт.
Уравнение Клаузиуса
Давление газа на стенки сосуда пропорционально концентрации молекул и средней кинетической энергии поступательного движения молекул.
![]()
Давление газа - это ударение молекул о стенки сосуда, которые движутся с большими скоростями.
Уравнение Больцмана
![]() для одноатомной
молекулы
для одноатомной
молекулы
![]() -
постоянная Больцмана
-
постоянная Больцмана
![]()
Средняя кинетическая энергия поступательного движения молекул пропорциональна термодинамической температуре и зависит только от нее.
Подставим уравнение Больцмана в уравнение Клаузиуса , получим:
![]()
- уравнение Клаузиуса (другая форма записи)
Универсальная газовая постоянная.
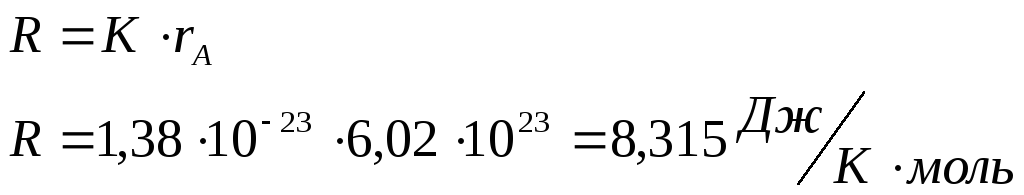
Основные процессы и понятия.
Введем понятие средней длины свободного пробега молекул.
![]() -
длина свободного пробега молекулы - это
расстояние, которое молекула проходит
между двумя последовательными
столкновениями (
-
длина свободного пробега молекулы - это
расстояние, которое молекула проходит
между двумя последовательными
столкновениями (![]() м).
Она зависит от температуры, давления
и концентрации молекул.
м).
Она зависит от температуры, давления
и концентрации молекул.
Речь идет именно о средней длине свободного пробега молекул, так как все молекулы газа движутся хаотично и разными скоростями. Очевидно, что при таком движении различные молекулы проходят разное расстояние от одного столкновения до следующего.
Состояние газа характеризуется следующими параметрами: P, V, T.
Различают три вида изопроцессов:
изотермический (T=const)
изобарический (P=const)
изохорический (V=const)
Экспериментальные газовые законы.
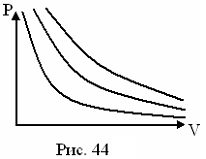
Закон Бойля-Мариотта (изотермический процесс, T=const)
При постоянной Т давление изменяется обратно пропорционально объему (рис.22).
![]()
Рисунок 22.
Закон
Гей-Люссака
(изобарический процесс, P=const)
–
![]()
При увеличении температуры, скорость молекул увеличивается и они разлетаются на большие расстояния
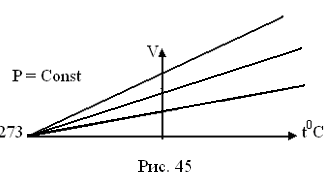
Рисунок 23.
При постоянном давлении объем газа изменяется линейно с температурой (рис.23).
Закон
Шарля
(изохорический процесс, V=const)
–
![]() .
При увеличении температуры молекулы
сильнее ударяются о стенки сосуда.
.
При увеличении температуры молекулы
сильнее ударяются о стенки сосуда.
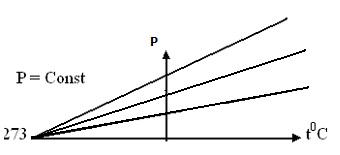
Рисунок 24.
При постоянном объеме давление газа изменяется линейно с температурой (рис.24).
Молекулы газа движутся с различными скоростями. Скорость движения молекул газа зависит от его температуры. Так как скорости отдельных молекул различны, то имеет смысл говорить о средней скорости молекул газа при данной температуре.
Получим выражение для средней квадратической скорости поступательного движения молекул:
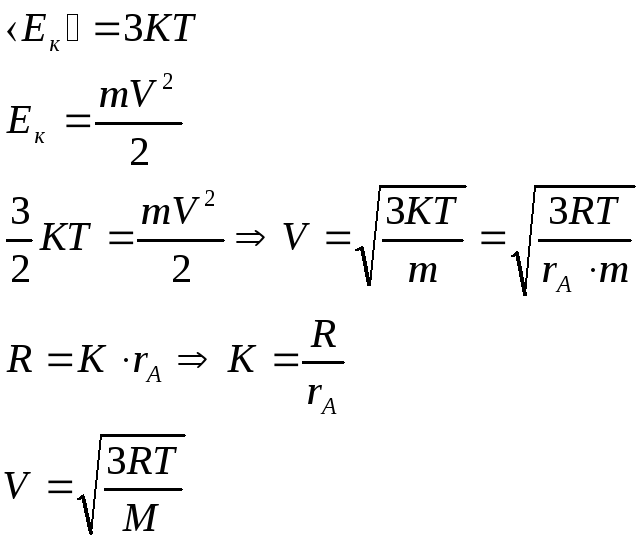
Средняя квадратическая скорость поступательного движения молекул пропорциональна корню квадратному из термодинамической температуры.
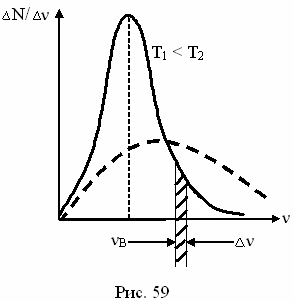
Распределение молекул газа по скоростям (по Максвеллу).
На графике (рис.25) представлена кривая распределения молекул по скоростям. Все молекулы газа движутся с различными скоростями.
Наибольшее число молекул обладают
средней скоростью, а большой и маленькой –
обладает незначительное количество молекул.
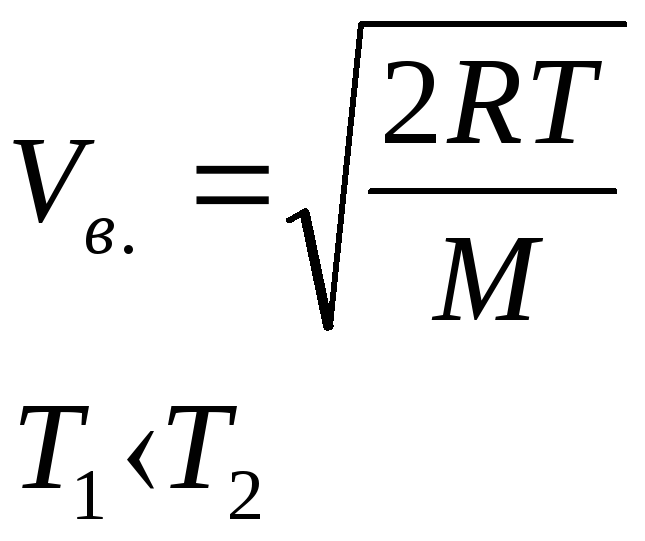 наиболее вероятная
скорость молекул
наиболее вероятная
скорость молекул
Рисунок 25.
Понятие идеального газа
.
Идеальным газом называется воображаемая модель газа, молекулы которого представляют собой материальные точки и силами взаимодействия, между молекулами можно пренебречь.
Получим уравнение
состояния идеального газа
( Менделеева
- Клапейрона) –
![]() (
(![]() -
концентрация молекул).
-
концентрация молекул).
![]()
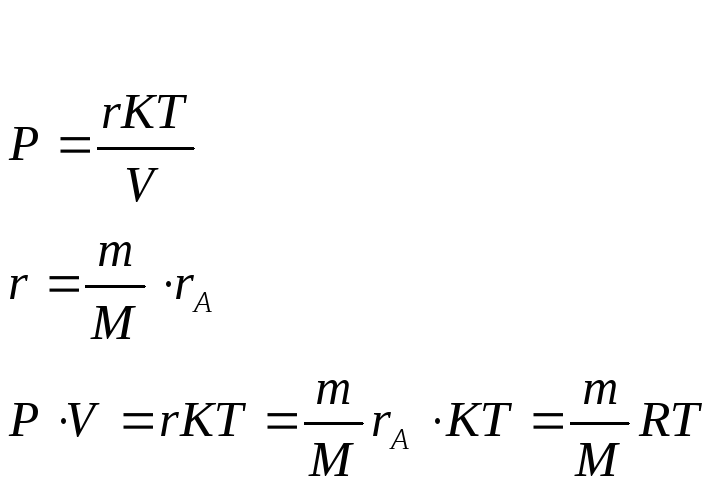
Получаем:
![]()
уравнение состояния идеального газа
Реальный газ – при рассмотрении реальных газов учитывают размеры, форму и силы взаимодействия между молекулами.
Уравнение
состояния реального газа. (Ван-Дер-Ваальса)
–
![]() ,где
,где
![]() давление
реального газа;
давление
реального газа;
![]() -объем самих
молекул.
-объем самих
молекул.
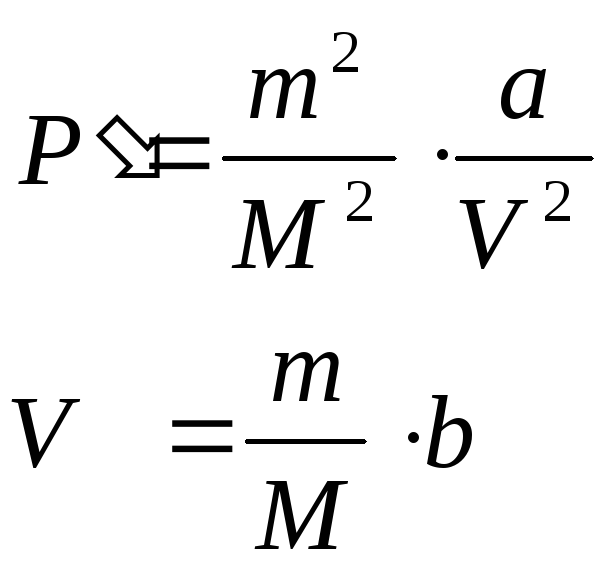
![]() некоторый
коэффициент
некоторый
коэффициент
