
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Окислительно-восстановительные реакции
При химических реакциях число и характер связей между взаимодействующими атомами могут меняться, т.е. могут изменяться степени окисления атомов в молекулах.
Реакции, в результате которых изменяются степени окисления атомов, называются окислительно-восстановительными.
Примеры окислительно-восстановительных реакций (сокращенно ОВР):
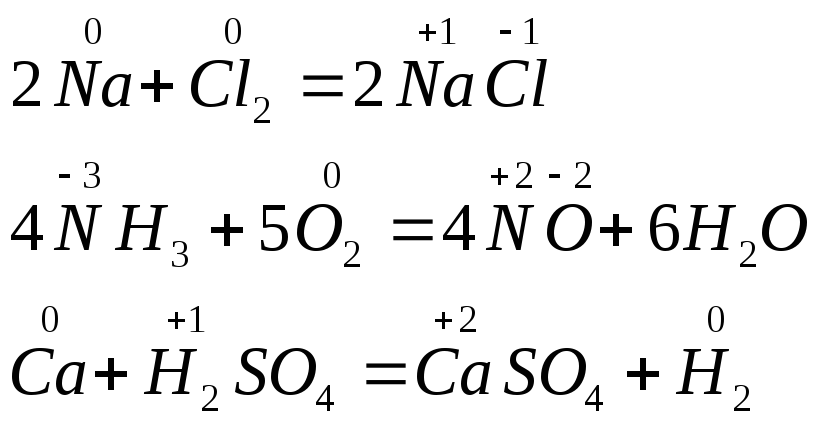
Изменение степени окисления связано со смещением или передачей электронов. Независимо от того, переходят ли электроны с одного атома на другой или лишь частично оттягиваются одним из атомов, условно говорят об отдаче и присоединении электронов.
Процесс отдачи электронов атомом или ионом называется окислением. Процесс присоединения электронов называется восстановлением.
Вещества, атомы или ионы которых отдают электроны, называются восстановителями. В ходе реакции они окисляются. Вещества, атомы или ионы которых присоединяют электроны, называются окислителями. В ходе реакции они восстанавливаются.
Процессы окисления и восстановления изображаются электронными уравнениями, в которых указывается изменение степени окисления взаимодействующих атомов и число электронов, отданных восстановителем или принятых окислителем.
Примеры уравнений, выражающих процессы окисления:

Уравнения, выражающие процессы восстановления:
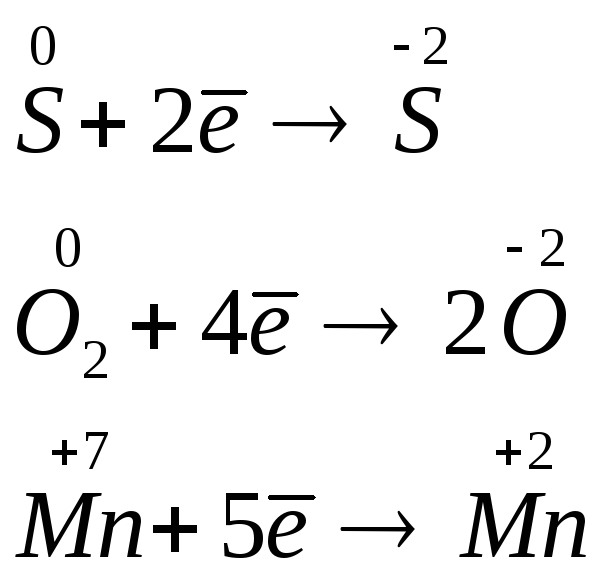
Окислительно-восстановительная реакция – это единый процесс, в котором окисление и восстановление протекают одновременно. Окисление одного атома всегда сопровождается восстановлением другого и наоборот. При этом общее число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
В соответствии с законом эквивалентов массы реагирующих веществ относятся друг к другу как молярные массы их эквивалентов. Эквивалентное количество вещества в ОВР зависит от числа электронов, отдаваемых или присоединяемых его атомами; молярная масса эквивалента рассчитывается по формуле:
![]() , (1)
, (1)
где М – молярная масса вещества, г/моль
Мэкв – молярная масса эквивалента вещества, г/моль
![]() –число
отдаваемых или присоединяемых .электронов
–число
отдаваемых или присоединяемых .электронов
Например, в реакции
![]()
атом
марганца присоединяет 5 электронов,
поэтому эквивалентным количеством
![]() является 1/5моль,
а атом серы
отдает 2 электрона и эквивалентным
количеством
является 1/5моль,
а атом серы
отдает 2 электрона и эквивалентным
количеством
![]() является 1/2моль.
Молярные массы эквивалентов соответственно
равны
является 1/2моль.
Молярные массы эквивалентов соответственно
равны
![]()
![]() .
.
Типы окислительно-восстановительных реакций
Различают три типа химических ОВР: межмолекулярные, внутримолекулярные и реакции самоокисления-самовосстановления. Отдельную группу составляют электрохимические реакции.
1. Межмолекулярные ОВР — это реакции, в которых окислитель и восстановитель являются разными веществами:
![]()
![]()
2. Внутримолекулярные ОВР — это реакции, в которых меняются степени окисления разных атомов одной молекулы:
![]()
3. Реакции самоокисления-самовосстановления — это реакции, в которых происходит окисление и восстановление атомов одного и того же элемента:
![]()
4. Электрохимические реакции — это ОВР, в которых процессы окисления и восстановления разделены пространственно (протекают на отдельных электродах), а электроны передаются от восстановителя к окислителю по внешней электрической цепи:
![]()
Окислительно-восстановительные реакции обычно имеют сложный характер, но, зная формулы реагентов и продуктов реакции и умея определять степени окисления атомов, можно легко расставить коэффициенты в уравнении любой ОВР.
