
Молекулярная биология клетки. Том 1
.pdf
181
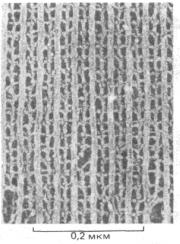
Рис. 4-12. Электронная микроскопия тонкого слоя золота позволяет выявить отдельные атомы в виде отдельных ярких пятен. Расстояние между соседними атомами золота около 0,2 нм. (С любезного разрешения Graham Hills.)
которых менее одной десятой длины волны света (0,025 мкм). Отдельные микротрубочки можно увидеть и с помощью флуоресцентной микроскопии (см. рис. 4-56). Однако в обоих случаях неизбежны эффекты дифракции, сильно изменяющие изображение. Диаметр микротрубочек при этом завышается (0,2 мкм), что не позволяет отличать отдельные микротрубочки от пучка из нескольких микротрубочек. Для решения этой задачи необходим электронный микроскоп, предел разрешения которого сдвинут далеко за пределы длины волны видимого света.
4.1.7. Электронный микроскоп позволяет анализировать тонкую структуру клетки [6]
Взаимосвязь длины волны света и предела разрешения (см. рис. 4-4) сохраняется для любой формы излучения, как для световых лучей, так и для электронов. Однако в последнем случае предел разрешения существенно ниже. Длина волны электрона уменьшается с увеличением его скорости. В электронном микроскопе с напряжением 100000 В длина волны электрона равна 0,004 нм, а согласно теории, разрешение такого микроскопа составляет 0,002 нм. Однако коррекция аберрации электронных линз - задача более сложная, чем для стеклянных линз, и поэтому в реальности разрешение современных электронных микроскопов в лучшем случае 0,1 нм (1 А) (рис. 4-12). Более того, трудности приготовления образца, его повреждение излучением существенно снижают нормальное разрешение, которое для биологических объектов составляет 2 нм (20 А) (т.е. примерно в 100 раз выше, чем у светового микроскопа).
Некоторые из достижений в развитии электронной микроскопии перечислены в табл. 4-2.
Общая схема просвечивающего электронного микроскопа (ПЭМ) напоминает схему светового, хотя электронный микроскоп значительно больше и как бы перевернут (рис. 4-13). Источник излучения - нить катода, испускающая электроны с вершины цилиндрической колонны высотой около двух метров. Поскольку при столкновении с молекулами воздуха электроны рассеиваются, в колонне должен быть создан вакуум. Электроны, излучаемые катодной нитью, ускоряются ближайшим анодом и проникают через крошечное отверстие, формируя электронный луч, проходящий в нижнюю часть колонны. Вдоль колонны на некотором расстоянии расположены кольцевые магниты, фокусирующие электронный луч, подобно стеклянным линзам, фокусирующим луч света в световом микроскопе. Образец через воздушный шлюз помещают в вакуум колонны, на пути электронного пучка. Часть электронов в момент прохождения через образец рассеивается согласно плотности вещества в данном участке, остаток электронов фокусируется и образует изображение (подобно формированию изображения в световом микроскопе) на фотопластинке или на фосфоресцирующем экране.
4.1.8. Для наблюдения под электронным микроскопом биологические образцы необходимо подвергнуть специальной обработке [7]
Применение электронного микроскопа в биологии позволило увидеть в клетках множество удивительных структур. Но прежде, чем эти открытия были сделаны, ученым пришлось изрядно потрудиться, чтобы разработать новые методы заключения тканей, их резки и окрашивания.
182
Таблица 4-2. Основные вехи в истории электронной микроскопии
1897 - Томсон (J. J. Thomson) сообщил о существовании отрицательно заряженных частиц, названных позже электронами 1924 - Де Бройль (de Broglie) предположил, что движущийся электрон обладает волновыми свойствами
1926 - Буш (Busch) доказал, что с помощью цилиндрических магнитных линз можно сфокусировать электронный луч. Так были заложены основы электронной оптики
1931 - Руска (Ruska) и соавторы создали первый просвечивающий электронный микроскоп
1935 - Кнолль (Knoll) показал возможность создания сканирующего электронного микроскопа; спустя три года фон Ардене (Von Ardene) cконструировал его прототип
1939 – Сименс (Siemens) создал первый просвечивающий электронный микроскоп, который нашел широкое применение. 1944 - Уильяме и Виков (Williams, Wyckoff) разработали метод оттенения металлом
1945 - Портер, Клод и Фуллам (Porter, Claude, Fullam) использовали электронный микроскоп для изучения клеток в культурах тканей после их фиксации и окраски
1948 - Пиз и Бейкер (Pease, Baker) представили убедительные доказательства, что ими получены тонкие срезы биологического материала (толщиной 0,1-0,2 мкм)
1952 - Паладе, Портер и Шестранд (Palade, Porter, Sjostrand) разработали методы фиксации и приготовления тонких срезов. Это позволило впервые увидеть многие внутриклеточные структуры. Хаксли (Н. Е. Xuxley) был одним из первых, кто применил эти методы, и ему удалось показать, что скелетная мышца содержит перекрывающиеся сети белковых филаментов. Так были получены доказательства в пользу гипотезы «скользящих нитей», объясняющей сокращение мышцы
1953 - Портер и Блюм (Porter, Blum) разработали ультрамикротом, который первым нашел широкое применение. В нем были использованы многие принципы, предложенные ранее Клодом и Шестрандом (Claude, Sjostrand)
1956 - Глауэрт (Glauert) и сотрудники показали, что смола аралдит является высокоэффективным средством для заключения препаратов в электронной микроскопии. Пятью годами позже Люфт (Luft) предложил другую смолу для заключения - эпон
1957 - Робертсон (Robertson) первым наблюдал в электронный микроскоп и описал трехслойное строение клеточной мембраны
1957 - Метод «замораживание-скалывание», разработанный Стиром (Steere), был усовершенствован Муром и Мюреталером (Moor, Muhlethaler). Позже (в 1966 г.), Брентон (Branton) показал, что данный метод позволяет изучать внутреннее строение мембран 1959 - Бреннер и Хорн (Bretftier, Home) усовершенствовали метод негативного контрастирования, который был разработан Холлом
(Hall) четырьмя годами ранее, после чего этот метод вошел в широкую практику
1959 - Сингер (Singer) использовал антитела, связанные с ферритином, для выявления молекул клетки с помощью электронной микроскопии
1963 - Сабатини, Бенш и Баррнетт (Sabatini, Bensch, Barrnett) начали использовать глутаральдегид (с последующей обработкой OsO4) в качестве фиксатора для электронной микроскопии
1965 - Фирма «Кембридж Инструменте» (Cambridge Instruments) впервые выпустила для продажи сканирующий электронный микроскоп 1968 - Де Розьер и Клуг (de Rosier, Klug) описали метод определения трехмерных структур по электронным микрофотографиям
1975 - Хендерсон и Унвин (Henderson, Unwin) впервые определили тонкое строение мембранного белка, используя реконструкцию электронных микрофотографий неокрашенных белков на компьютере
1979 - Хейзер, Рис (Heuser, Reese) и сотрудники разработали высокоразрешающий метод глубокого травления, основанный на сверхбыстром замораживании

183
Рис. 4-13. Схематическое изображение основных узлов светового микроскопа, а также просвечивающего и сканирующего электронных микроскопов, подчеркивающее сходные черты в конструкции этих приборов. В электронных микроскопах обоих типов образец должен быть помещен в вакуум.
Рис. 4-14. Глутаральдегид и тетраоксид осмия наиболее распространенные фиксаторы, используемые в электронной микроскопии. Две реакционноспособные альдегидные группы глутаральдегида позволяют сшивать различные типы молекул с помощью ковалентных связей, вытесняющих атомы водорода (выделены цветом). Тетраоксид . осмия восстанавливает многие органические соединения, с которыми образует поперечно-сшитые комплексы. Это свойство особенно ценно в случае клеточных мембран, поскольку тетраоксид осмия реагирует с двойными связями С -С, характерными для многих жирных кислот.
Рис. 4-15. Схематическое изображение медной сеточки, используемой для поддержания тонких срезов образца в просвечивающем электронном микроскопе.
В электронном микроскопе все образцы подвергаются действию вакуума высокой степени разрежения и поэтому их невозможно наблюдать в живом влажном состоянии. Ткани обычно сохраняют с помощью фиксации - сначала глутаральдегидом, ковалентно связывающим белковые молекулы между собой, а затем осмиевой кислотой, связывающей и стабилизирующей двойной слой липидов и белки (рис. 4-14). Электроны обладают низкой проникающей способностью, этим вызвана необходимость получения срезов толщиной от 50 до 100 нм (1/200 толщины одной клетки). Только такие срезы можно наблюдать в электронный микроскоп. Для этого потребовалось также предварительное обезвоживание образца и пропитка мономерными смолами, которые после полимеризации создают твердый блок пластмассы, заключающий образец; блок затем режут с помощью тонкого стеклянного или алмазного ножа на специальном микротоме. Полученные срезы не содержат воды или иных летучих органических веществ; такие срезы помещают на небольшую круглую металлическую сетку для наблюдения под микроскопом
(рис. 4-15).
Контраст, создаваемый в электронном микроскопе, определяется атомным числом веществ образца. Чем выше атомное число, тем больше электронов рассеивается и тем выше контраст. В состав биологических молекул входят атомы с очень низким атомным числом (в основном кислород, водород, углерод и азот). Для усиления контраста образцы до и после резки импрегнируют солями тяжелых металлов, таких, как осмий, уран и свинец. Компоненты клетки выявляются с разной степенью контраста согласно степени их импрегнации (или окраски) этими солями. Как правило, липиды окрашиваются осмием в темный цвет и это позволяет выявлять мембраны (рис. 4-16).
С помощью методов электронной микроскопии в некоторых случаях на тонких срезах удается локализовать специфические макромолекулы. Некоторые ферменты клеток выявляются после инкубации образцов с субстратами, ферментативная реакция с которыми приводит к местному отложению электроноплотного осадка (рис. 4-17). Кроме того, для локализации специфических макромолекул можно использовать
184
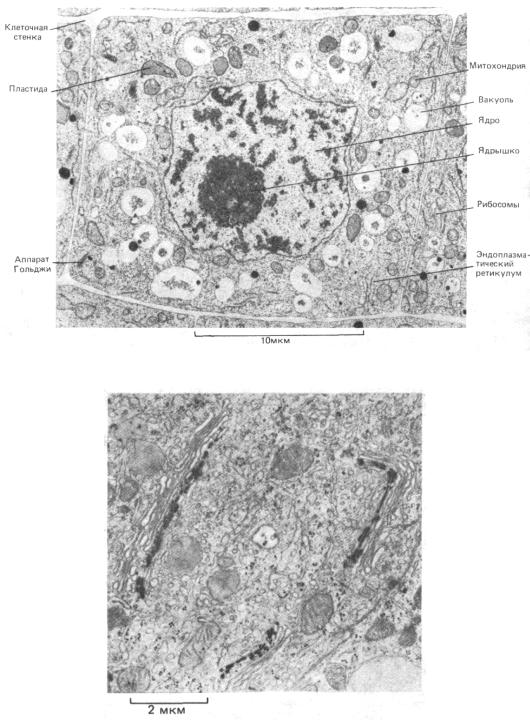
Рис. 4-16. Тонкий срез верхушки корня злака. Легко различимы клеточная стенка, ядро, вакуоли, митохондрии, эндоплазматический ретикулум, аппарат Гольджи и рибосомы. (С любезного разрешения Brian Gunning.)
Рис. 4-17. Электронная микрофотография клетки, иллюстрирующая локализацию конкретного фермента (нуклеотиддифосфатазы) в аппарате Гольджи. Тонкий срез клетки инкубирован с субстратом, образующим под действием фермента электроноплотный осадок. (С любезного разрешения Daniel Friend.)
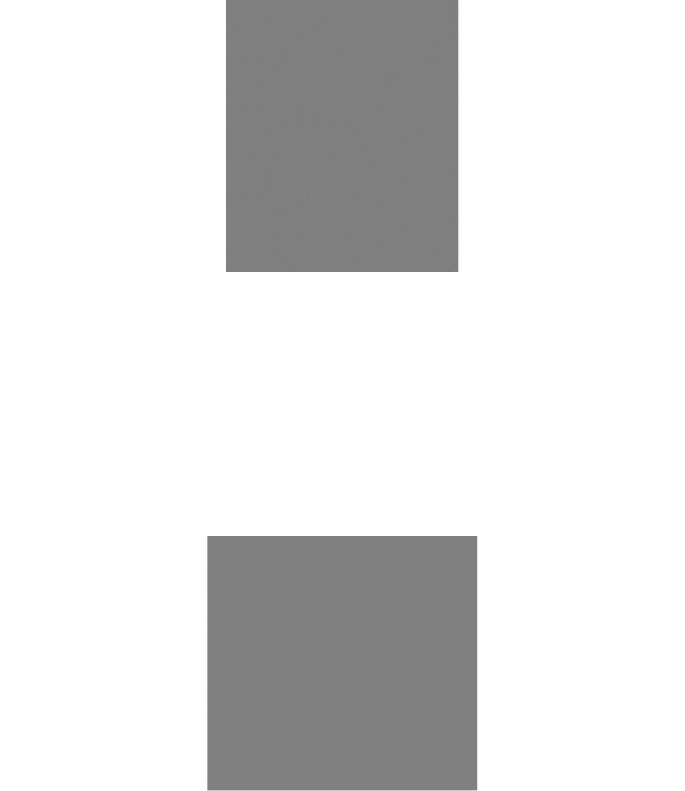
185
Рис. 4-18. Схематическое изображение, иллюстрирующее, как легко прийти к ошибочным выводам, изучая отдельные тонкие срезы. Так, например,
вданном случае рассматриваются срезы клетки, в которой имеется лишь одна разветвленная митохондрия. Между тем создастся впечатление, что большинство срезов содержит две или три отдельные митохондрии. Более того, может показаться, что на срезах 4 и 7 выявляемая митохондрия находится в процессе деления. Серийные срезы позволяют реконструировать реальную форму, существующую в действительности.
меченые антитела, если их связать с индикаторным ферментом пероксидазой или электроноплотным маркером, например, частицами коллоидного золота (см. разд. 4.5.3).
4.1.9. Сканирующий электронный микроскоп используется для получения трехмерного изображения поверхности
[8]
Тонкие срезы практически являются двумерными срезами ткани и не позволяют судить о трехмерной структуре клеточных компонентов. Трехмерное изображение можно получить после реконструкции сотен серийных срезов (рис. 4-18), но это долгий и утомительный процесс. В настоящее время разработаны более прямые методы получения трехмерного изображения. Один из них состоит в изучении образца под сканирующим электронным микроскопом (СЭМ), который обычно меньше и проще, чем просвечивающий электронный микроскоп. Для получения изображения в просвечивающем электронном микроскопе используют электроны, проходящие через образец, а в сканирующем электронном микроскопе используются электроны, рассеиваемые или излучаемые поверхностью образца. В данном случае образец должен быть зафиксирован, высушен и покрыт тонкой пленкой тяжелого металла. Затем образец сканируется очень узким пучком электронов. При этом оценивают количество электронов, рассеиваемых при облучении последовательных точек металлической поверхности. Полученное значение используют для контроля интенсивности второго луча, движущегося синхронно первому и формирующему изображение на телевизионном экране. Таким образом происходит формирование единого, цельного и значительно увеличенного изображения.
Рис. 4-19. Полученная с помощью сканирующего электронного микроскопа микрофотография стереоцилий, расположенных в виде органных труб на поверхности волосковых клеток внутреннего уха. (С любезного разрешения R. Jackobs, A.J. Hudspeth.)

186
Рис. 4-20. Электронная микрофотография отдельных молекул белка миозина (оттенение платиной). Миозин основной компонент сократительного аппарата мышц; здесь можно увидеть, что он состоит из двух глобулярных участков, связанных с общим палочковидным хвостом. (С любезного разрешения
Arthur Elliot.)
Рис. 4-21. Схематически показан метод приготовления реплики с поверхности образца (оттенение металлом).
Обратите внимание, что толщина слоя металла определяется контуром поверхности исходного образца.
Метод сканирующей электронной микроскопии обеспечивает значительную глубину фокусировки; более того, поскольку масштабы рассеивания электронов определяются углом поверхности по отношению к лучу, на изображении возникают чередующиеся светлые и темные участки, создающие впечатление трехмерности (рис. 4-19). Но этот метод применим только для изучения поверхности и его разрешение сравнительно невелико (около 10 нм с эффективным увеличением примерно 20 тыс. раз). Данный метод практически неприменим для изучения субклеточных органелл и используется исключительно для изучения целых клеток и тканей.
Используя обычные тонкие срезы, поворачивая их и фотографируя их под разными углами, можно и в обычном просвечивающем электронном микроскопе получить имитацию трехмерного изображения. При наблюдении в стереоочки полученной стереопары изображений объекта возникает псевдотрехмерное изображение. Толщина образцов, изучаемых этим методом, определяется проникающей способностью электронов или их энергией. Совершенствование метода привело к созданию высоковольтных микроскопов с ускоряющим напряжением до 1 млн. вольт (против 100 тыс. вольт у обычных ПЭМ). Эти гигантские приборы позволяют изучать по методу просвечивающей электронной микроскопии срезы толщиной в несколько микрометров.
4.1.10. Для изучения деталей поверхности в просвечивающем электронном микроскопе используют оттенение [9]
Просвечивающий электронный микроскоп можно использовать для изучения поверхности образца с очень большим увеличением, наблюдая отдельные макромолекулы. Как и при сканирующей электронной микроскопии, на высушенный образец напыляется тонкая пленка тяжелого металла, например, платина. Металл напыляется под определенным углом, так что отложения напыленной пленки в некоторых местах толще, чем в других. Этот процесс известен как оттенение здесь возникает эффект тени, создающий впечатление трехмерности изображения.
Приготовленные таким образом образцы могут быть достаточно малы и тонки, чтобы электронный луч проникал сквозь них; например, таким способом можно анализировать индивидуальные молекулы. вирусы и стенки клеток (рис. 4- 20). Что же касается более толстых образцов, то здесь после оттенения необходимо удалить органический материал клетки, при этом на поверхности образца останется только . тонкий металлический отпечаток или реплика поверхности. Эта реплика затем усиливается углеродной пленкой, после чего ее можно поместить на сетку и изучать в обычном электронном микроскопе (рис. 4-21).|
4.1.11. Методы электронной микроскопии замораживаниескалывание и замораживание травление обеспечивают уникальную возможность наблюдать внутреннее строение клетки [10]
В клеточной биологии особенно успешно используются два метода, основанные на получении механических реплик. Один из них - метод электронной микроскопии «замораживание-скалывание» - дает возможность изучать внутреннее строение клеточных мембран. Клетки замораживают при температуре жидкого азота (-196°С) в присутствии криопротектора (антифриза) во избежание искажений за счет образования кристаллов льда. Замороженный блок затем раскалывают

187
Рис. 4-22. Электронная микрофотография тилакоидной мембраны хлоропластов клетки растений, полученная по методу замораживанияскалывания. Тилакоидные мембраны, осуществляющие фотосинтез, уложены в виде множества слоев. Плоскость скола переходит с одного слоя на другой и проходит через середину каждого липидного бислоя. Внутримембранные белки, которые содержатся в значительном количестве внутри двойного слоя, обнажаются и после натенения выявляются в виде внутримембранных частиц в этой платиновой реплике. Самой крупной частицей, выявляемой на мембране, является комплекс из множества белков, образующих фотосистему II. (С любезного разрешения L. F. Staehelin.)
Рис. 4-23. Электронная микроскопия по методу замораживания-травления. Замороженный образец раскалывают ножом (А). Затем, сублимируя воду под вакуумом, уменьшают слой льда и обнажают таим образом поверхность клетки (Б). После этого готовят реплику все еще замороженной поверхности (как описано в подписях к рис. 4-21) и проводят исследование с помощью просвечивающего электронного микроскопа.
188
Рис. 4-24. Регулярно уложенные белковые филаменты в мышце насекомых. Для получения этого изображения мышечные клетки были заморожены в жидком гелии, расколоты через цитоплазму и подвергнуты глубокому высушиванию. Затем была приготовлена металлическая реплика, которую изучали при большом увеличении. (С любезного разрешения Roger Cooke, John Heuser).
лезвием ножа. Скол часто проходит через гидрофобную середину двойного слоя липидов, обнажая внутреннюю поверхность клеточных мембран. Образующуюся поверхность скола оттеняют платиной, органический материал удаляют и изучают полученные реплики в электронном микроскопе (рис. 4-21). Такие реплики усеяны небольшими выпячиваниями - внутримембранными частицами, которые представляют собой крупные мембранные белки. Этот метод чрезвычайно удобен и эффективен при анализе распределения таких белков на поверхности мембраны (рис. 4-22).
Другой важный метод электронной микроскопии - метод «замораживания-травления» - используется для изучения внешней поверхности клеток и мембран. В данном случае клетки замораживают при очень низкой температуре и замороженный блок раскалывают лезвием ножа. Содержание льда вокруг клеток (и в меньшей степени внутри клеток) понижают возгонкой воды в вакууме при повышении температуры (процесс называют вакуумной сушкой) (рис. 4-23). Участки клетки, подвергнутые такому травлению, затем оттеняют (как было показано ранее) для приготовления платиновой реплики.
Метод замораживания - травления не позволяет использовать криппротекторы, поскольку они не летучи и по мере возгонки воды остаются в образце. Чтобы добиться высокого качества изображения, необходимо препятствовать образованию больших кристаллов льда. Это возможно при ускоренном замораживании образца (при скорости замораживания выше 20° С в миллисекунду). Один из методов такого быстрого замораживания состоит в использовании специального устройства. быстро сближающего образец с медным блоком, охлажденным до — 269°С жидким гелием. Особенно впечатляющие результаты получают после глубокого травления быстро замороженных клеток. Этот метод позволяет выявлять структуры внутреннего содержимого клеток, демонстрируя их трехмерную организацию с исключительной четкостью (рис. 4-24).
Поскольку в этом случае в микроскопе под вакуумом наблюдают не образцы, а реплики, полученные после оттенения металлом, методы замораживание - скалывание и замораживание - травление можно использовать для изучения замороженных нефиксированных клеток и исключить риск проявления артефактов, вызванных фиксацией.
4.1.12. Методы негативного контрастирования и криоэлектронной микроскопии обеспечивают высокое разрешение при анализе макромолекул
Используя для контрастирования оттенение солями тяжелых металлов, можно наблюдать в электронный микроскоп изолированные макромолекулы, например, ДНК или большие белки (см. рис. 4-20), а после негативного контрастирования разрешению поддаются даже мельчайшие детали. При приготовлении образцов для негативного контрастирования исследуемые молекулы наносят на тонкую пленку углерода (практически прозрачную для электронов), затем ее смачивают концентрированным раствором солей тяжелых металлов, например, уранилацетата. После высушивания образца тонкая пленка солей тяжелых металлов равномерно покрывает углеродную подложку, за исключением участков, занятых адсорбированными макромолекулами. Вещество макромолекул более проницаемо для электронов по сравнению с прилежащими участками, покрытыми солями тяжелых металлов; за счет этого возникает обращенное или негативное изображение молекулы. Негативное окрашивание используется особенно эффективно для наблюдения больших агрегатов макромолекул (вирусы, рибосомы) либо

189
Рис. 4-25. Электронные микрофотографии негативно окрашенных актиновых нитей. Диаметр каждой из этих нитей составляет примерно 8 нм. При тщательном исследовании видно, что актиновые нити состоят из двух спирально закрученных цепей глобулярных молекул актина. (С любезного разрешения Roger Craig.)
для наблюдения субъединичной структуры белковых филаментов (рис. 4-25).
Методы негативного контрастирования и оттенения обеспечивают высококонтрастное изображение поверхности небольших скоплений макромолекул, но разрешение этих методов ограничено размерами металлических частиц, образующих тень, либо молекул красителей, состоящих из солей тяжелых металлов, которые лишь грубо очерчивают поверхность молекулы или макромолекулярного ансамбля. Однако в настоящее время можно наблюдать с высоким разрешением даже внутренние детали трехмерных структур, таких, как вирусы. Для этого используют метод криоэлектронной микроскопии, где очень тонкий (примерно, 100 нм) быстро замороженный слой влажного образца помещают на микроскопическую решетку. С помощью специального приспособления гидратированный образец удерживают при — 160°С в вакууме микроскопа. Таким способом можно наблюдать материал практически непосредственно: без фиксации, окраски и сушки. Гомогенность витрифицированного водного слоя и использование недофокусированного фазового контраста позволяют получать удивительно четкие изображения таких неокрашенных образцов (рис. 4-26).
Вне зависимости от использованных методов отдельные белковые молекулы дают в электронном микроскопе слабые и плохо различимые изображения. Попытки извлечь информацию за счет удлинения времени наблюдения или повышения интенсивности освещающего луча тщетны, поскольку при этом имеет место разрушение наблюдаемого объекта. Для анализа деталей молекулярной структуры необходимо объединять информацию о многих молекулах, чтобы избежать случайных ошибок,
Рис. 4-26. Вирус леса Семлики в тонком слое неокрашенной вирифицированной воды (криоэлектронная микроскопия при — 160°С.) С помощью электронной обработки микрофотографий можно получить трехмерное изображение с высоким разрешением. (С любезного разрешения Jacques Duboshet; см. также S.D. Fuller, Cell, 48, 923-934, 1987.)
190
исходящих от индивидуальных изображений. Такой подход приемлем для изучения вирусов или белковых филаментов, отдельные субчастицы которых представлены в виде регулярно повторяющихся элементов; он пригоден также для изучения любых веществ, которые могут быть расположены в двумерной кристаллической решетке, где значительное число молекул сохраняют одинаковую ориентацию или разделены одинаковыми промежутками. Используя электронные микрофотографии структур, ориентированных подобным образом, можно применить методы обработки изображения и высчитать среднее изображение отдельных молекул, выявив детали, приглушенные случайным «шумом» исходного снимка.
Реконструкции изображения по этому методу позволяют получить детальную структуру оболочки вируса с разрешением в 3,5 нм, а детали формы индивидуальных макромолекул можно исследовать с разрешением 0,5 нм (5 А). Но даже наиболее изощренные методы электронной микроскопии не дают возможность полностью описать молекулярную структуру, поскольку атомы в молекулах разделены расстоянием около 0,1- 0,2 нм. Для изучения молекулярной структуры макромолекул на атомарном уровне необходимы иные методы - методы. в которых вместо электронов используются рентгеновские лучи.
4.1.13. Детальная структура молекул, образующих кристаллическую решетку, может быть рассчитана на основании полученных дифракционных картин [12]
Рентгеновские лучи, подобно свету, являются одной из форм электромагнитного излучения, но вследствие того, что длина волны рентгеновских лучей значительно короче, их применение позволяет разрешить значительно более мелкие детали. Однако в отличие от видимого света или потока электронов, рентгеновские лучи нельзя сфокусировать и после их прохождения через образец получить обычное изображение. Однако структуру образца можно выявить, используя метод дифракции рентгеновских лучей.
Сперва рассмотрим одиночный объект (например, отдельную молекулу), расположенный на пути любого излучения, длина волны которого меньше размеров объекта. Объект будет рассеивать часть излучения. Рассеянное излучение можно рассматривать как набор перекрывающихся волн, каждая из которых отражается разными участками объекта. Если волны перекрываются, они подвергаются интерференции и возникает распределение излучения, известное как дифракционная картина. Дифракционная картина может быть зарегистрирована на фотопластинке, помещенной на некотором расстоянии от предмета, или представлена с помощью количества рассеянного излучения, отраженного объектом в разных направлениях (рис. 4-27). Форма дифракционной картины определяется структурой объекта. С другой стороны, исходя из полного описания дифракционной картины, можно теоретически рассчитать структуру данного объекта. Опыт показывает, что дифракционная картина для отдельной молекулы чересчур слаба и недостоверна, и потому ее нельзя использовать в качестве отправной точки для теоретического анализа.
Предположим, что множество идентичных объектов расположено в кристаллической решетке и на них направлен пучок каких-то лучей (рис. 4-28). В этом случае общее количество рассеянного излучения значительно выше. Однако излучение, рассеянное одной молекулой, будет интерферировать с излучением, рассеянным другими молекулами. В некоторых направлениях индивидуальные рассеянные лучи будут усиливаться, образуя на дифракционной картине яркое пятно. Полная
