
- •Лекция 2
- •2.1 Второй закон термодинамики.
- •2.2 Энтропия и термодинамическая вероятность системы.
- •2.3 Расчет изменения энтропии в различных процессах.
- •2.3 Постулат Планка. Третий закон термодинамики.
- •2.4 Термодинамические потенциалы. Энергия Гиббса. Энергия Гельмгольца
- •2.5 Характеристические функции. Уравнения Гиббса–Гельмгольца.
- •Самопроизвольное протекание химической реакции. Расчет изменения энергии Гиббса в химических реакциях
- •Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •2.8 Активность и летучесть.
Химический потенциал.
Первый и второй законы термодинамики, из которых следуют фундаментальные уравнения, были получены для закрытых систем, т.е. систем, процессы в которых не приводят к изменению количества компонентов. Реально же чаще встречаются системы, в которых при различных процессах изменяются количества компонентов. Это может происходить, скажем, при фазовых превращениях или вследствие протекания химической реакции. При этом может изменяться состав как отдельных частей, так и системы в целом.
Поэтому внутренняя энергия (и другие функции состояния) открытых систем будут изменяться не только за счет сообщения системе теплоты и произведенной системой работы, но и за счет изменения состава системы. Следовательно для открытых систем характеристические функции будут функциями не только их двух естественных переменных, но и функциями числа молей всех веществ , составляющих систему:
U = U ( S, v, n1……………….nk )
H = H ( S, p, n1 ………….. nk )
F = F ( T, v, n1…………… nk )
G = G ( T, p, n1……………nk )
Полный дифференциал внутренней энергии открытой системы можем записать
как
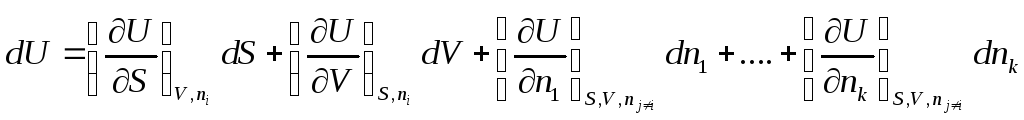
Индекс nj≠i означает, что число молей других веществ, кроме данного, не изменяется.
Но если открытая система изменяет свое состояние при постоянном составе (все ni =const), то она ничем не отличается от закрытой системы, поэтому
![]() и
и
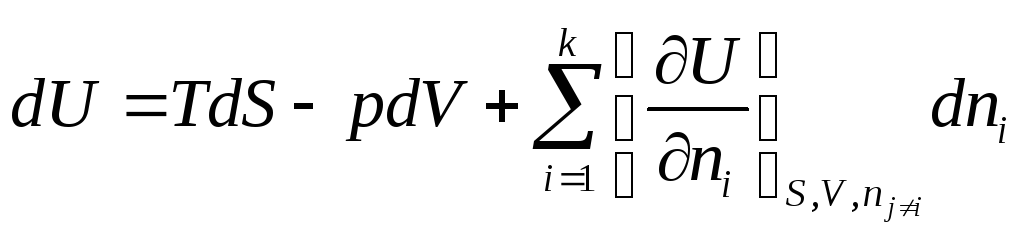
Гиббс
назвал частную производную 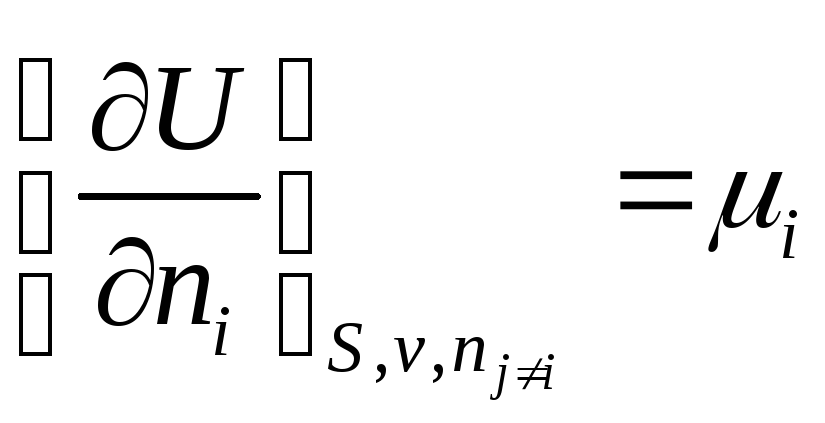 химическим
химическим
потенциалом i –ого компонента.
Аналогично

Поскольку H≡ U + pV, F ≡ U – TS, G ≡ U – TS + pv
то dH = dU + pdV + Vdp
dF = dU – TdS – SdT
dG = dU – TdS – SdT + Vdp + pdV
и подставив сюда
![]()
получаем
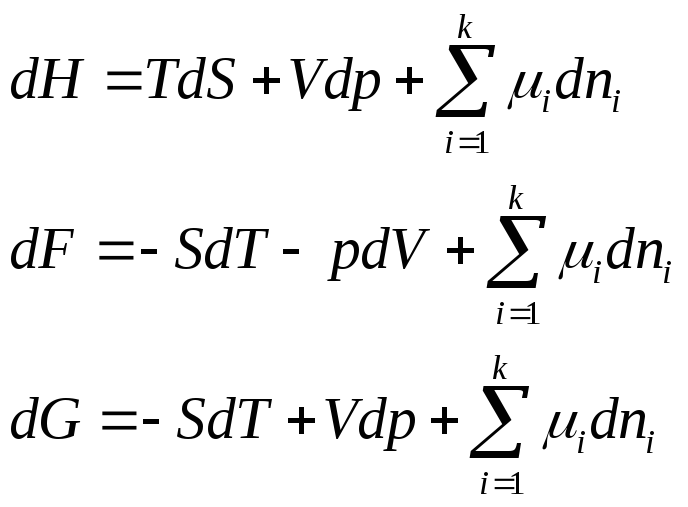
Сравнив выражение для полных дифференциалов характеристических функций, получаем
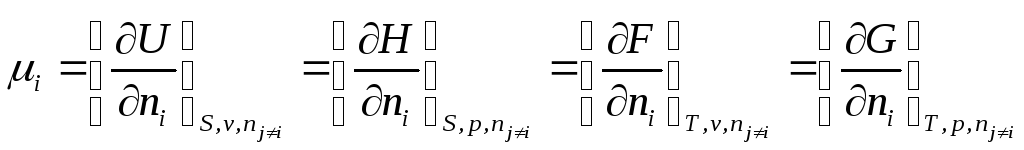
т.е. химический потенциал компонента равен приращению характеристической функции системы при добавлении одного моля данного компонента при условии, что естественные переменные и состав системы остаются постоянными, т.е. система достаточно велика.
Для системы, состоящей из одного вещества, справедливо:
![]() , (61)
, (61)
Любая экстенсивная функция состояния является функцией количества вещества в системе.
Поэтому, если система состоит из нескольких компонентов, то
![]() , (62)
, (62)
где ni– число молейi-го компонента. Продифференцируем (62) по ni
p, Т, nj≠i=const
![]() (63)
(63)
Величину
![]() Гиббс
назвалхимическим потенциалом и
обозначил μiЕго ещё называютпарциальной мольной
энергией Гиббса(парциальная
термодинамическая функция Гиббса)
Гиббс
назвалхимическим потенциалом и
обозначил μiЕго ещё называютпарциальной мольной
энергией Гиббса(парциальная
термодинамическая функция Гиббса)
![]()
Можно дать следующее определение химического потенциала:
Это изменение энергии Гиббса однородной многокомпонентной системы при добавлении к ней 1 моля данного компонента при постоянных давлении, температуре и составе системы (т.е. добавление должно происходить при бесконечно больших количествах всех компонентов, чтобы состав системы не изменился).
Химическийпотенциал в отличие от, например, энергии Гиббса G, – интенсивная величина, т.е. он не зависит от массы системы, а зависит от природы системы и ее состава, температуры и давления. Вообще говоря,iзависит от силы химического взаимодействия данного компонента с другими компонентами: чем это взаимодействие сильнее, тем меньшеi. Сила взаимодействия зависит от концентрации компонента, причем, чем меньше концентрацияi-ого компонента, тем взаимодействие сильнее, и тем меньшеi. Вещество стремится переходить из состояния, где егобольше, в состояние, где егоменьше (т.е. туда, где сильнее взаимодействие данного компонента с другими компонентами).
Любая энергетическая характеристика есть произведение интенсивного фактора на экстенсивный. В нашем случае μi– интенсивный параметр, а ni– экстенсивный. Тогда:
![]() при T,
p = const. (64)
при T,
p = const. (64)
Введение
некоторого количества dniмолей
i–го компонента при постоянном количестве
других компонентов и постоянных Т и р
будет увеличивать значение энергии
Гиббса на величину![]() .
Аналогичные изменения будут вызваны
прибавлением других компонентов. Общее
изменение энергии Гиббса системы при
добалении в нее нескольких компонентов
равно:
.
Аналогичные изменения будут вызваны
прибавлением других компонентов. Общее
изменение энергии Гиббса системы при
добалении в нее нескольких компонентов
равно:
![]() ,(65)
,(65)
или, в общем случае,
![]() (66)
(66)
Это уравнение получило название фундаментального уравнения Гиббса.
Проинтегрируем соотношение (64) при постоянном составе системы (т.е. когда i = const):
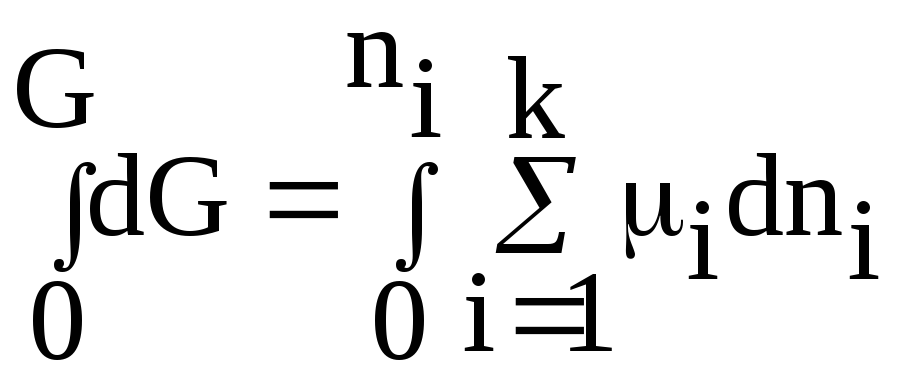 ,
,
получим:
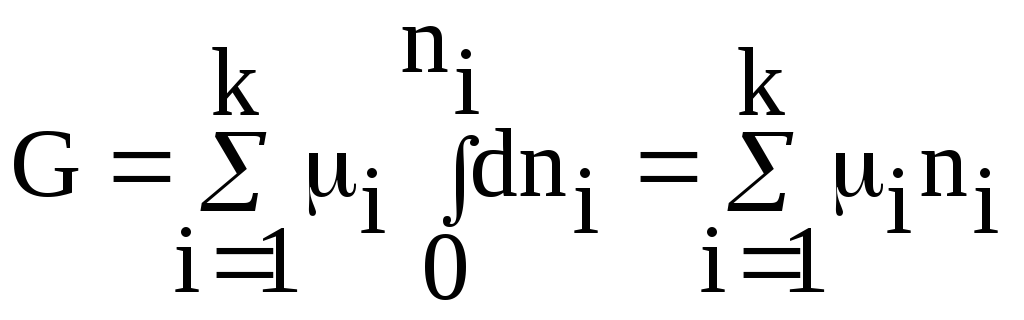 (67)
(67)
Соотношение (67) иногда называется уравнением Гиббса-Дюгема (чаще данное уравнение записывают таким образом:
![]() ,
где xi
молярная доля i-ого
компонента.)
,
где xi
молярная доля i-ого
компонента.)
При р, Т = const для химической реакции верно:
![]() . (68)
. (68)
Расчёт химического потенциала идеального газа:
Если
у нас есть один чистый компонент, то его
химический потенциал равен молярной энергии Гиббса![]() :
:
![]() .
. ![]() Но
Но
![]() (69)
(69)
(Здесь
![]() и
и ![]() – молярный объем и молярная энтропия
вещества), тогда получим:
– молярный объем и молярная энтропия
вещества), тогда получим:
![]() (70)
(70)
Пусть идеальный газ находится при Т = const, тогда
dT = 0 и
d
= ![]() dp
(71)
dp
(71)
Проинтегрируем выражение (71) от р0 = 1 атм до любого р и, соответственно, от 0 до ; получим:
![]() ;
;
![]() .
(72)
.
(72)
Но для идеального газа выполняется закон Менделеева–Клапейрона, который для 1 моль газа имеет вид:
р![]() = RT, отсюда
= RT, отсюда ![]() =
= ![]() .
(73)
.
(73)
Тогда получим:
![]() (74)
(74)
Если р0 = 1 атм, то
![]() (75)
(75)
В
уравнении (75) р – не само давление,
а безразмерная
величина,
численно равная давлению, выраженному
в атмосферах (![]() ).
).
0 – стандартный химический потенциал, т.е. химический потенциал при стандартном давлении р0 = 1 атм;
Если же имеется смесь газов, то для любого i-ого компонента смеси.
i
= 0i
+ RT
ln![]() (76
)
(76
)
Здесь
![]() – безразмерная величина, численно
равная парциальному давлению i-ого
компонента смеси (т.е. той части от общего
давления, которая приходится на i-ый
компонент), выраженному в атмосферах
(
– безразмерная величина, численно
равная парциальному давлению i-ого
компонента смеси (т.е. той части от общего
давления, которая приходится на i-ый
компонент), выраженному в атмосферах
(![]() ).
).
Так как
![]() ,
где
,
где![]() – мольная доля i–го газа в смеси, p –
общее давление в системе, то
– мольная доля i–го газа в смеси, p –
общее давление в системе, то
![]() .
.
