
- •6.1 Диаграммы плавкости двухкомпонентных систем.
- •1. Системы с неограниченной взаимной растворимостью компонентов в твердом и жидком состоянии (изоморфные смеси).
- •3. Диаграммы состояния бинарных систем с неограниченной растворимостью в жидком состоянии и ограниченной растворимостью в твердой фазе.
- •4. Системы, образующие устойчивые химические соединения, плавящиеся конгруэнтно.
- •6. Диаграмма состояния бинарных систем с образованием химического соединения с инконгруэнтной точкой плавления.
- •6.2 Диаграммы состояния трехкомпонентных систем.
- •6.3 Термический анализ.
ЛЕКЦИЯ 6
Диаграммы плавкости двухкомпонентных систем.
Трехкомпонентные системы, концентрационный треугольник Гиббса. Метод термического анализа.
6.1 Диаграммы плавкости двухкомпонентных систем.
Для двухкомпонентных гомогенных (однофазных) систем (Ф = 1) по правилу фаз Гиббса имеем:
f = K + 2 – Ф = 2 + 2 – 1 = 3, (1)
т. е. для описания состояния таких систем достаточно трёх переменных: давления, температуры и концентрации. Следовательно, для их графического изображения надо использовать объёмную (трёхмерную) диаграмму. Чтобы свести её к плоской, необходимо сократить число переменных. Поэтому при изучении конденсированных систем чаще всего строят диаграммы «точка кристаллизации (плавления) – состав» при постоянном давлении (обычно р = 1 атм.), благодаря чему диаграмма становится плоской.
Рассмотрим некоторые двойные системы различных типов.
1. Системы с неограниченной взаимной растворимостью компонентов в твердом и жидком состоянии (изоморфные смеси).
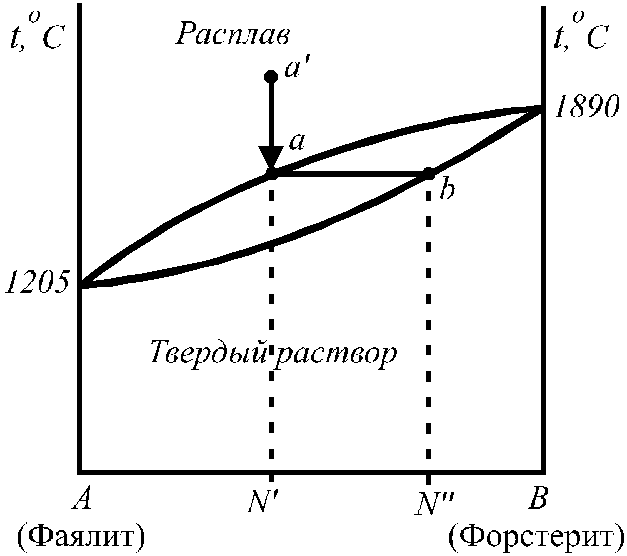
Рис. 1. Диаграмма состояния системы фаялит (Fe2SiO4) ‑ форстерит (Mg2SiO4)
На диаграмме, представленной на рис. 1, верхняя кривая (ликвидус) описывает зависимость температуры кристаллизации (плавления) от состава жидкого раствора (расплава), нижняя кривая (солидус) — зависимость температуры плавления от состава твердого раствора. Такие системы обычно образуют вещества, которые имеют одинаковый тип и близкие параметры кристаллической решетки (например, системы: медь – никель, золото – серебро) Состав выпадающих кристаллов не совпадает с составом равновесной с ними жидкости. В случае значительных отклонений от идеальности жидкого раствора на диаграмме состояния появляются экстремумы (например, для системы Сu – Au на диаграмме состояния есть минимум Тпл).
2. Плоская диаграмма плавкости (р = const) двухкомпонентных систем с неограниченной растворимостью компонентов в жидком состоянии и взаимной нерастворимостью в твердом состоянии (без образования химических соединений).
Т акие
диаграммы называют диаграммами
эвтектического типа.
акие
диаграммы называют диаграммами
эвтектического типа.
Особенностью диаграммы эвтектического типа является то, что при кристаллизации смеси состава (3) происходит одновременное выпадение кристаллов А и В.
Эвтектика – это не твердый раствор, а микрогетерогенная смесь кристаллов.
Жидкость, которая находится в равновесии с двумя кристаллическими фазами одновременно, называется эвтектической жидкостью, ее состав – эвтектическим составом, температура, при которой существует такое равновесие, называется температурой эвтектики (эвтектической температурой).
При кристаллизации смеси неэвтектического состава (точки 2 и 4) сначала выпадают кристаллы только того компонента, которого в данной смеси больше по сравнению с эвтектическим составом (в точках 2 и 4, это ‑ соответственно, А и В компоненты). При этом жидкость обогащается другим компонентом, а ее состав постепенно приближается к эвтектическому. Температура кристаллизации остающейся жидкости с изменением ее состава понижается. Когда температура достигнет эвтектической, образуется эвтектический расплав. Дальнейшая кристаллизация протекает при постоянной температуре (f = 0). При эвтектической температуре одновременно выпадают кристаллы обоих компонентов А и В. На всей линии CED состав расплава соответствует точке Е !
Линия ТАЕТВ называется линией ликвидуса, она показывает зависимость температуры начала кристаллизации расплава от состава расплава.
Линия CED называется линией солидуса, она показывает зависимость температуры конца кристаллизации расплава от его состава.
Выше линии ликвидуса система находится в жидком состоянии, а ниже линии солидуса – в твердом состоянии.
