
- •Лекция 5
- •5.1 Растворы, их общая характеристика.
- •5.2 Закон Рауля
- •Закон Генри.
- •5.3 Диаграммы состояния жидкость-пар для бинарных систем
- •5.4 Законы Коновалова. Азеотропные смеси.
- •5.5 Ограниченная взаимная растворимость жидкостей. Взаимно нерастворимые жидкости.
- •5.6 Распределение вещества в двух несмешивающихся растворителях. Закон распределения Нернста-Шилова.
- •5.7 Растворимость газов и твердых веществ в жидкостях
- •5.8 Эбулиоскопия. Криоскопия
Лекция 5
Растворы,
их общая характеристика, способы
выражения состава растворов. Растворимость
твердых веществ и газов в жидкостях.
Идеальные растворы, законы Вант-Гоффа,
Рауля и Генри. Криоскопия и эбулиоскопия.
Диаграммы
состояния раствор — пар для бинарных
систем.
Законы Коновалова, азеотропные смеси.
Ограниченная взаимная растворимость
жидкостей. Взаимно нерастворимые
жидкости. Распределение вещества в двух
несмешивающихся растворителях. Закон
распределения Нернста-Шилова.
5.1 Растворы, их общая характеристика.
Раствором можно назвать гомогенную систему, состоящую из двух или большего числа компонентов, состав которой в определенных пределах может непрерывно изменяться.
Компонент – составная часть раствора, которая может быть выделена из раствора в индивидуальном виде, т. е. в виде чистого вещества.
Растворы классифицируют
1) по степени дисперсности
— истинные (молекулярные или атомные смеси компонентов);
— коллоидные (микрогетерогенные);
— тонкие механические взвеси (суспензии и эмульсии).
2) по агрегатному состоянию
— газовые;
— жидкие;
— твёрдые.
3) с термодинамических позиций
— идеальные;
— предельно разбавленные (С2→ 0);
— реальные.
Физическая химия изучает термодинамические и другие свойства растворов. Коллоидные растворы и тонкие механические взвеси являются предметом исследования коллоидной химии. Мы будем подробно рассматривать только жидкие растворы.
В жидких растворах обычно различают растворительирастворенное вещество,хотя с термодинамической точки зрения эти составляющие раствора равноценны. Свойства растворителя обычно обозначаются индексом (1), а свойства растворенных веществ – индексами (2), (3) и т. д.
Растворителем считают то вещество, которое имеется в растворе в большем количестве.Растворенные вещества– остальные компоненты, присутствующие в растворе в меньших количествах.
Существуют различные способы выражения концентраций компонентов.
1) молярная
(мольная) доля
![]() – безразмерная величина; (1)
– безразмерная величина; (1)
или
![]() .
.
Здесь ni – количество i-ого компонента (моль).
При
этом
![]() или
или![]() .
.
2) молярность, т.е. количество i-ого компонента в молях, содержащееся в 1 литре раствора.
![]() ,
(2)
,
(2)
V – объем раствора в литрах, [ci] = моль/л.
3) массовая доля (W) или массовое содержание данного компонента, выраженное в %
![]() ,
или
,
или ![]() (3)
(3)
Здесь Mi – масса i-ого компонента.
4) объемная доля i или i(%)
![]() ,
или
,
или ![]() ,
(4)
,
(4)
где Vi – объем i-ого компонента, V – объем всей системы.
5) моляльность (mi) или моляльная концентрация – количество i-ого компонента в молях, приходящееся на 1000 г растворителя.
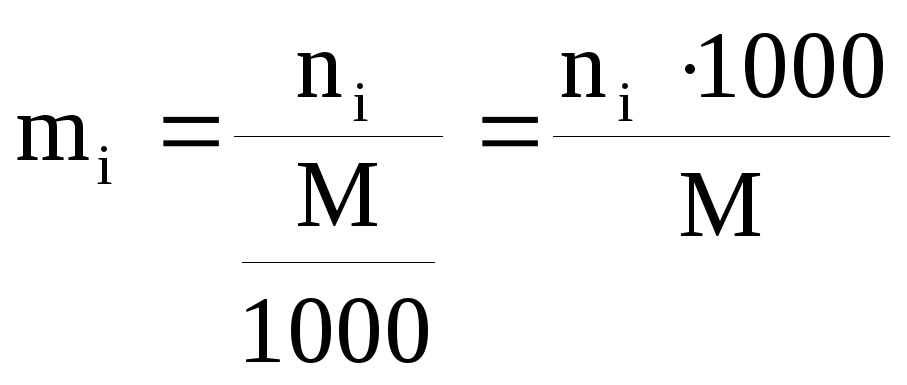 ,
моль/1000 г растворителя, (5)
,
моль/1000 г растворителя, (5)
где ni – число молей i-ого компонента, М – масса растворителя в граммах.
Уравнение Гибса-Дюгема.
Известно, что в химической термодинамике одной из важнейших величин является химический потенциал (парциальная мольная энергия Гиббса), определяемая по уравнению:
![]() .
.
При постоянных риТсправедливо:
![]() (6)
(6)
С другой стороны, суммарная энергия Гиббса системы равна
![]() .
(7)
.
(7)
Продифференцируем уравнение (7):
![]() .
(8)
.
(8)
Сравнивая (6) и (8), получаем
![]() .
(9)
.
(9)
вводим мольную долю разделив все слагаемые суммы на ni
xidI=0 (10)
Уравнение (9) получило название уравнение Гиббса-Дюгема и широко используется в термодинамике растворов.
