
Лекция 4
Фазовые
равновесия. Правило фаз Гиббса. Уравнение
Клапейрона-Клаузиуса. Диаграммы
состояния однокомпонентных систем.
4.1 Фазовые равновесия.
Системы бывают гомогенными (однородными) и гетерогенными (неоднородными). Гомогенная системасостоит из одной фазы, агетерогенная – из нескольких фаз
Фаза – совокупность всех гомогенных (однородных) частей системы, имеющих одинаковый состав, химические и физические свойства и отделенных от других частей системы поверхностью раздела.
Составляющие вещества системы(s) это все те химические вещества, которые могут быть выделены из данной системы, могут существовать вне ее длительное время и из которых затем можно составить данную систему.
Пример 4.1. Раствор NaCl в воде. Здесь два составляющих вещества: NaCl и вода, хотя присутствуют и ионы Na+, Cl, H+, OH).
Независимые компоненты (k)– это те вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы, находящейся в равновесии.
Число независимых компонентов k – это наименьшее количество составляющих веществ, с помощью которых можно выразить состав каждой фазы.
Число независимых компонентов k не всегда совпадает с числом составляющих веществ s:
k = s q,
где q – число уравнений связи, которые могут связывать между собой концентрации каких-либо веществ в равновесной системе.
Пример 4.2.Смесь трех газов (HI, I2, H2), находящаяся в равновесии. Этогомогенная однофазная система. Здесь есть три составляющих вещества – HI, I2, H2. В системе возможна следующая реакция:
H2 газ+ I2
газ![]() 2HIгаз
2HIгаз
При равновесии между концентрациями (или парциальными давлениями) веществ выполняется следующее соотношение (уравнение связи):
 (или
(или
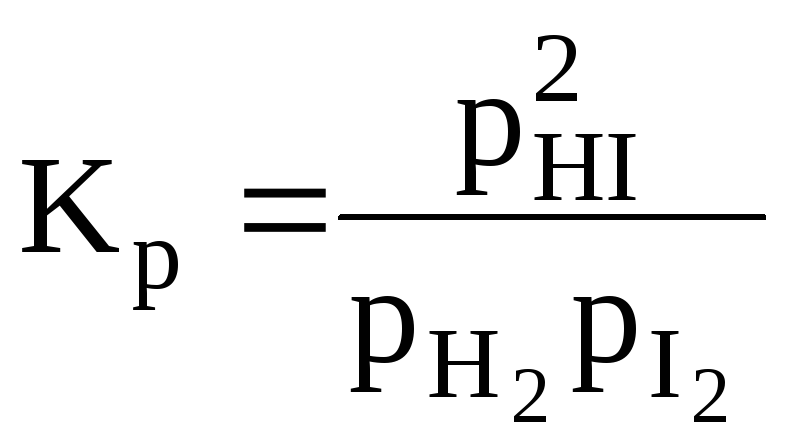 )
)
Т.е., зная концентрации двух любых веществ, можно найти концентрацию третьего вещества. Поэтому в системе будет только два независимых компонента: k=sq=3–1=2.
В
общем случае состояние каждой фазы
определяется давлением, температурой
и ее составом (например, молярной
долей каждого компонента
![]() ).
При этом давление и температура являютсявнешними
параметрами.
).
При этом давление и температура являютсявнешними
параметрами.
Диаграмма состояния гетерогенной системы – это графическое выражение связи между р, Т и составом отдельных фаз равновесной системы.
На диаграммах состояния различают фазовые и фигуративные точки. Фазовой точкой называется точка на диаграмме состояния, изображающая состояние равновесной фазы, т.е. давление, температуру и состав.
Фигуративная точка системы – это точка на диаграмме состояния, которая выражает р, Т и состав всей системы в целом (а не состав отдельной фазы!).
4.2 Правило фаз Гиббса.
Пусть имеется система, состоящая из трех фаз (I), (II), (III). Тогда условия равновесия можно записать следующим образом:
р(1) = р(11) = р(111) – условие механического равновесия,
Т(1) = Т(11) = Т(111) – условие термического равновесия,
i(1) = i(11) = i(111) – условие химического равновесия.
Из анализа этих условий и было получено правило фаз Гиббса, которое обычно формулируют следующим образом:
Число степеней свободы (f) равновесной термодинамической системы, на которую влияют только температура (Т) и давление (р), равно числу независимых компонентов системы (k) минус число фаз (Ф) плюс 2.
Математически правило фаз Гиббса записывается так: f = k – Ф + 2.
Число степеней свободы – это число независимых переменных, которые можно изменять произвольно в некоторых пределах так, чтобы число и природа фаз остались прежними.
Число степеней свободы характеризует вариантность системы, которая в зависимости от величины f может быть следующей:
1) нонвариантная система (безвариантная, f = 0),
2) моновариантная система (одновариантная, f = 1),
3) бивариантная система (двухвариантная, f = 2) и т.д.
На практике часто рассматривают влияние только одного переменного внешнего параметра на систему (т.е. берут или постоянное давление (тогда Тconst), или постоянную температуру (тогда pconst)). В этом случае n=1 и правило фаз Гиббса имеет вид:
f = k – Ф + 1. (единица относится к переменному внешнему параметру).
Пример 4.3 Определить число компонентов в системах:
a) Н2(г) + I2(г) = 2НI(г),
б) СaCO3(тв) = СaO(тв) + СO2(г).
Решение. a) В этой системе имеется одно уравнение, связывающее концентрации состовляющих частей:
H2(г) + I2(г) = 2HI(г)
 ,
,
следовательно,
число компонентов в этой системе
равно: ![]() .
.
б) В этой системе также имеется только одно уравнение:
CaCO3(тв) → СaO(тв) + СO2(г)
![]() ,
,
следовательно, система будет двухкомпонентной, поскольку
![]() .
.
