
- •Лекция 5
- •5.1 Растворы, их общая характеристика.
- •5.2 Закон Рауля
- •Закон Генри.
- •5.3 Диаграммы состояния жидкость-пар для бинарных систем
- •5.4 Законы Коновалова. Азеотропные смеси.
- •5.5 Ограниченная взаимная растворимость жидкостей. Взаимно нерастворимые жидкости.
- •5.6 Распределение вещества в двух несмешивающихся растворителях. Закон распределения Нернста-Шилова.
- •5.7 Растворимость газов и твердых веществ в жидкостях
- •5.8 Эбулиоскопия. Криоскопия
5.2 Закон Рауля
Изменение термодинамических функций при образовании растворов.
Процесс растворения твердых веществ в жидкостях с образованием истинных растворов можно мысленно разбить на три стадии:
ориентация полярных частиц (молекул) растворителя вокруг частиц растворяемого вещества (Н1> 0);
разрушение кристаллической решётки (Н2> 0);
сольватация частиц растворенного вещества в растворе (Н3< 0).
Суммарный тепловой эффект образования раствора равен:
![]() .
.
Образование растворов при смешении двух (и более) жидкостей или растворении газа (газов) в жидкости также сопровождается тепловыми эффектами, связанными с ослаблением связей между частицами растворителя и появлением новых связей между частицами растворителя и растворенных веществ.
Образование любого раствора — процесс самопроизвольный и всегда сопровождается увеличением энтропии: раствS = mixS > 0, при проведении его в условиях постоянной температуры и давления энергия Гиббса должна уменьшаться (т.е. G < 0).
Идеальные растворы образуются лишь в том случае, если вещества, образующие раствор, очень близки по своим свойствам (например, два изотопа или два соседних гомолога). На практике в большинстве случаев при смешении жидких компонентов образуются реальные растворы. В идеальном растворе, состоящем из двух жидких компонентов А и В, все типы взаимодействия (FA-A=FB-B=FA-B) - равноценны. При образовании идеального раствора из отдельных компонентов:
тепловой эффект смешения равен нулю (теплота не выделяется и не поглощается), т.е. Нсмеш. = 0;
объем системы не изменяется, т.е. Vсмеш. = 0;
3) изменение энтропии при образовании идеального раствора совпадает (равно) с изменением энтропии при смешении идеальных газов (для 1 моль смеси Sсмеш. = – R(хAlnxA + xBlnxB).
Здесь хA и xB – молярные доли компонентов A и B, соответственно. При этом идеальные растворы образуются самопроизвольно за счет увеличения энтропии (Sсмеш. > 0), поскольку Нсмеш. = 0. Кроме того, идеальные растворы подчиняются закону Рауля (рi = p0,i xi) для всех компонентов при всех температурах и концентрациях.
Реальные (неидеальные) растворы не подчиняются закону Рауля. Это бывает, когда силы взаимодействия между однородными молекулами компонентов, из которых образуется раствор, не равны силам взаимодействия между разнородными молекулами компонентов в растворе. (FA-AFB-BFA-B) При этом многие реальные растворы образуются с выделением или с поглощением теплоты (т.е. Нсмеш. 0), с изменением объема (т.е. Vсмеш. 0), а изменение энтропии при их образовании не всегда соответствует соотношению Sсмеш. = R(xAlnxA + xB lnxB).
Закон
Рауля.
Рассмотрим двухкомпонентную систему
А–В, компоненты которой неограниченно
растворимы друг в друге в жидком состоянии
и при любых соотношениях
образуют идеальный раствор. При нагревании
таких растворов в пар переходят оба
компонента, поэтому пар состоит из двух
веществ. Общее давление насыщенного
пара над раствором равно робщ = рА + рВ,
где рА
и рВ
– парциальные давления компонентов А
и В соответственно. При этом молярные
доли компонентов в паре
(yА, уВ),
в соответствии с законом Дальтона, будут
равны:
![]() ;
;![]() .
.
хА, хВ – молярные доли компонентов А и В в жидкой фазе (растворе);
В 1887 г. Рауль экспериментально установил, что при любой заданной температуре парциальное давление насыщенного пара любого компонента над жидким идеальным раствором прямо пропорционально его молярной доле в растворе.
Это и есть закон Рауля, математически его можно записать в виде:
рА = р0,АхА; рВ = р0,ВхВ, где (11)
р0,А, р0,В – давление насыщенного пара над чистыми жидкими компонентами А и В при данной температуре.
В общем виде математическое выражение закона Рауля можно записать следующим образом:
pi = p0,ixi.
И зобразим
графически данные зависимости (это
будут уравнения прямых линий):
зобразим
графически данные зависимости (это
будут уравнения прямых линий):
Реальные(неидеальные) раcтворы не подчиняются законам идеальных растворов Рауля в форме pi= p0ixi. Отношение pi/ p0iдля реальных растворов равно уже не мольной доле, а некоторой функции от температуры и состава раствора:ai = f (T, xi), которую Дж. Льюис назвалтермодинамической активностью i-ого компонента в растворе. В связи с этим для реальных растворов будут иметь место два равенства:
![]() ,
(12)
,
(12)
если
пар подчиняется законам идеальных газов
и
![]() если пар подчиняется законам реальных
газов. Активность связана с мольной
долей компонента через коэффициент
активности
если пар подчиняется законам реальных
газов. Активность связана с мольной
долей компонента через коэффициент
активности![]() :
:
ai ![]()
Величина коэффициента активности указывает на степень отклонения реальных растворов от идеальности (законов идеальных растворов).
Если давление насыщенного пара над реальным раствором больше, чем над идеальным раствором того же состава (i > 1), то отклонения от идеальности называются положительными.
При этом, силы взаимодействия (F) между однородными молекулами компонентов раствора больше сил взаимодействия между разнородными молекулами компонентов раствора (т.е. FАА > FАВ или FВВ > FАВ), и переход компонентов в пар будет энергетически более выгодным. Растворы с положительным отклонением от закона Рауля образуются обычно с поглощением теплоты ( 0) и увеличением объема (V 0).
Если давление насыщенного пара над реальным раствором меньше, чем над идеальным раствором того же состава (i< 1), то отклонения от идеальности называютсяотрицательными
При этом силы взаимодействия (F) между однородными молекулами компонентов раствора меньше сил взаимодействия между разнородными молекулами компонентов раствора (т.е. FАА < FАВ или FВВ < FАВ), то переход компонентов в пар будет энергетически менее выгодным. Такие растворы обычно образуются с выделением теплоты ( < 0) и уменьшением объема (V < 0).
Графически положительные и отрицательные отклонения от закона Рауля для двухкомпонентных систем обычно изображаются следующим образом:
П оложительные
отклонения.
оложительные
отклонения.
Пунктирная линия – для идеального раствора.
Отрицательные отклонения.
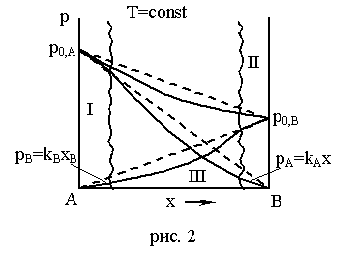
Рассмотрим три области: I, II, III.
Область I – это разбавленный раствор компонента В в А (здесь А – растворитель). В области I давление насыщенного пара растворителя (компонента А) подчиняется закону Рауля (сплошная линия совпадает с пунктирной), а для растворенного вещества В – не подчиняется закону Рауля.
Область II – здесь растворителем является компонент В, а компонент А является растворенным веществом. В этой области давление насыщенного пара компонента В подчиняется закону Рауля, а компонента А – не подчиняется.
Области I и II – это области предельно разбавленных растворов.
