
- •Лекция 2
- •2.1 Второй закон термодинамики.
- •2.2 Энтропия и термодинамическая вероятность системы.
- •2.3 Расчет изменения энтропии в различных процессах.
- •2.3 Постулат Планка. Третий закон термодинамики.
- •2.4 Термодинамические потенциалы. Энергия Гиббса. Энергия Гельмгольца
- •2.5 Характеристические функции. Уравнения Гиббса–Гельмгольца.
- •Самопроизвольное протекание химической реакции. Расчет изменения энергии Гиббса в химических реакциях
- •Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •2.8 Активность и летучесть.
2.5 Характеристические функции. Уравнения Гиббса–Гельмгольца.
Характеристическими функциями называются такие функции состояния системы, посредством которых и их частных производных могут быть выражены в явной форме все термодинамические свойства системы.
Из дифференциальной формы объединенного первого и второго законов термодинамики для обратимых процессов выразим величину dU:
TdS = dU + A' + pdV, откуда
dU = TdS – A' – pdV. (45)
Если полезная работа отсутствует (т.е. A' = 0), то получим:
dU = TdS – pdV (46)
Вспомним теперь следующие соотношения:
G H – TS = U + pV – TS (47)
F U – TS (48)
Если найти значения полных дифференциалов dG, dF из соотношений (43)(44) и учесть соотношение (46) для dU, то можно получить следующие выражения для dG, dF:
dG = dU + pdV + Vdp TdS SdT =Vdp – SdT (49)
dF = dU TdS SdT = – pdV – SdT (50)
На основании соотношений (49)–(50) можно прийти к выводам, что
G = G(р, Т); F = F(V, Т),
тогда, записав значения соответствующих полных дифференциалов для dG, dF через соответствующие частные производные, например,
![]()
![]() ,
,
и сравнив их с выражениями (49)–(50), можно получить следующие выражения для определения термодинамических свойств:
![]() (51);
(51); ![]() (53);
(53);
![]() (52);
(52); ![]() (54).
(54).
Таким образом, мы показали, что G, F являются характеристическими функциями.
C помощью полученных выше соотношений можно получить выражения, называемые уравнением (или уравнениями) Гиббса-Гельмгольца. Из уравнений (47) и (48) легко получить следующие выражения, учитывая, что температура – постоянная:
G = H – TS (55)
F = U – TS (56)
Так как,
![]() ,
то (57)
,
то (57)
![]() ,
(58)
,
(58)
![]() .
(59)
.
(59)
Последние два равенства
и есть искомые зависимости
![]() и
и![]() от температуры и их называют уравнениями
Гиббса-Гельмгольца.
от температуры и их называют уравнениями
Гиббса-Гельмгольца.
Самопроизвольное протекание химической реакции. Расчет изменения энергии Гиббса в химических реакциях
Самопроизвольно
может протекать та реакция, для которой
![]() <0.
<0.
Стандартное изменение энергии Гиббса в ходе химической реакции можно рассчитать как разность между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
![]() , (60)
, (60)
где ν – стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
![]()
По знаку
![]() можно
определить может ли реакция протекать
самопроизвольно при p=1атм
можно
определить может ли реакция протекать
самопроизвольно при p=1атм
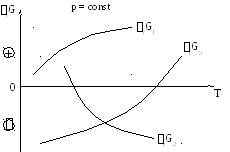
Пусть имеются три химические реакции (1-3), для которых известны значения rG1, rG2, rG3 при различных температурах. Построим графики зависимостей G = f (T). Например, получим следующую картину:
При постоянных давлении и температуре реакция (1) термодинамически невозможна при всех температурах, т.к. для нее G1 0 при всех температурах. Реакция (2) может протекать самопроизвольно при высоких температурах (там, где G2 0), но не может протекать при низких температурах (там, где G2 0). Реакция (3) может протекать самопроизвольно при низких температурах (G3 0), но не может протекать при высоких температурах (G3 0).
1
3
2
