
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
Скорость реакции в целом будет
![]()
Так как стадия а) является обратимой, то для нее
![]()
где
Kpавн.
-
константа равновесия,
![]() ‑ исходная концентрация катализатора.
‑ исходная концентрация катализатора.
Отсюда
![]() ,
,
тогда
![]() .
.
Из последнего уравнения следуют некоторые важные выводы:
Скорость реакции пропорциональна исходной концентрации катализатора
 .
.В общем случае порядок реакции будет дробным.
Если СA×Kpавн. » 1, то w = k3×
 и реакция становится реакцией нулевого
порядка по исходному веществуА.
Это значит, что весь катализатор связан
в промежуточный комплекс и скорость
реакции определяется его количеством.
и реакция становится реакцией нулевого
порядка по исходному веществуА.
Это значит, что весь катализатор связан
в промежуточный комплекс и скорость
реакции определяется его количеством.Если СA×Kpавн. « 1, то w = k3kpCA
 ,
а реакция будет реакцией первого порядка
по исходному веществуА.
,
а реакция будет реакцией первого порядка
по исходному веществуА.
nA = 1
Таким образом порядок реакции меняется в зависимости от концентрации реагента (исходного вещества А). Такой особенностью обладают только каталитические реакции.
Ферментативный катализ.
Исключительное значение в гомогенном катализе занимает ферментативный катализ - основа жизнедеятельности животных и растений. Ферменты состоят либо целиком, либо в основном из белков.
Каталитической активностью обладает не вся молекула фермента, а лишь определенный ее участок, называемый активным центром. Активный центр соединяется с молекулой реагирующего вещества, образуя непрочное промежуточное соединение, способное к дальнейшим превращениям. При этом активный центр вступает в соединение только с теми молекулами, структура которых подобна структуре активного центра. Этим, по-видимому, объясняется специфичность действия ферментов.
Активность ферментов зависит от рН среды, температуры.
Для описания кинетики ферментативных реакций используют уравнение Михаэлиса-Ментен.
Рассмотрим вывод кинетического уравнения для гомогенного каталитического процесса на примере реакции с одним исходным веществом (субстратом) S, которое превращается в продукт P в присутствии катализатора Е (в частности, таким катализатором может быть фермент):
E
+ S ES
![]() E+P
E+P
Скорость реакции будет
w = k3CES
Используя метод стационарных концентраций можно записать
![]()
k1CECS = k2CES + k3CES
Следовательно
![]() (14)
(14)
Уравнение материального баланса по ферменту:
![]()
Следовательно, текущая концентрация фермента будет:
![]()
Подставим СЕ в уравнение (14)
![]() (15)
(15)
Выразим из уравнения (15) концентрацию ферментно-субстратного комплекса ES
(k2
+ k3)CES
= k1![]() CS
-
k1CESCS
CS
-
k1CESCS
![]()
Делим числитель и знаменатель на k1CS. Получим:
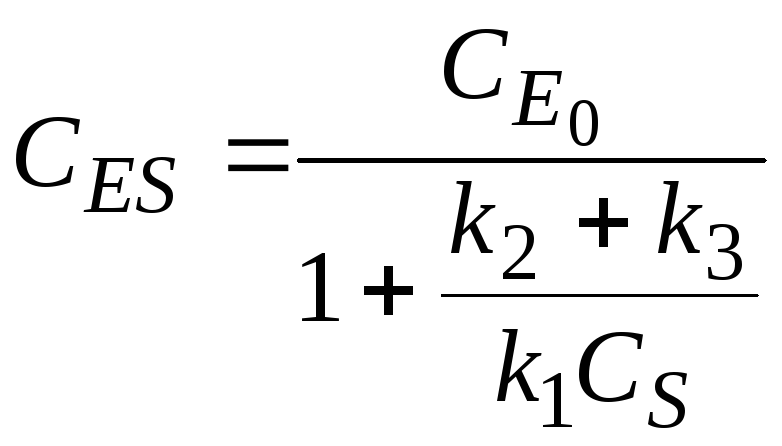 .
.
Обозначим
![]()
где kM - константа Михаэлиса.
Окончательно для скорости ферментативной реакции:
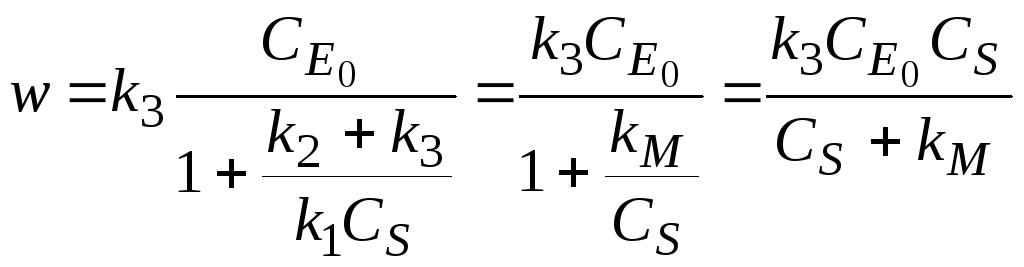
Когда CS « kM, скорость образования продукта прямо пропорциональна CS. Если CS » kM, то скорость образования продукта не зависит от CS и имеет максимальную величину
![]() .
.
Физический
смысл этого уравнения заключается в
том, что при больших концентрациях
исходного вещества весь катализатор
входит в состав промежуточного соединения
ES.
Концентрация ES
достигает предельного значения
![]() .
Следовательно
и скорость получения продукта достигает
предельной для данного количества
катализатора величины, обозначаемой
wmax.
.
Следовательно
и скорость получения продукта достигает
предельной для данного количества
катализатора величины, обозначаемой
wmax.
