
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
11.1 Теория активных столкновений
Теория активных столкновений (ТАС) основана на молекулярной теории газов, согласно которой в газовой фазе существует определенное распределение частиц по скоростям (распределение Максвелла) и энергиям (распределение Больцмана). Согласно представлений ТАС, для взаимодействия частицы должны столкнуться. Рассмотрим бимолекулярную реакцию:
А + В ® D.
Общее число столкновений частиц А и В в газовой фазе зависит от целого ряда факторов: температуры, концентрации частиц, размеров и свойств частиц, скорости их движения.
Согласно молекулярно-кинетической теории газов, общее число столкновений молекул А и В (ZAB) в единице объема в единицу времени определяется соотношением:
![]() (1)
(1)
где
![]() -
некоторый параметр, зависящий от свойств
и геометрии сталкивающихся частиц.
-
некоторый параметр, зависящий от свойств
и геометрии сталкивающихся частиц.
![]() ~
~![]() ,
n-число частиц в единице объема
,
n-число частиц в единице объема
Однако не все столкновения частиц А и В приводят к реакции. Взаимодействие частиц происходит лишь тогда, если столкновения окажутся активными, то есть если частицы будут обладать определенным запасом энергии. Следовательно, необходимо учитывать распределение частиц по энергиям.
ZABакт. < ZAB
ZABакт. =
![]()
где
![]() -
Больцмановский множитель, учитывающий
распределение частиц по энергиям (для
молекул, имеющих энергию Е).
-
Больцмановский множитель, учитывающий
распределение частиц по энергиям (для
молекул, имеющих энергию Е).
Однако определяемые экспериментально скорости реакций оказываются значительно меньшими.
Это связано с тем, что еще необходимо учитывать тот факт, что при столкновении частицы (молекулы) должны быть определенным образом ориентированы, а их избыточная энергия должна быть сосредоточена по линиям разрываемых связей. Поэтому в уравнение для скорости вводят дополнительный множитель - стерический фактор Р:
Р £ 1.
Тогда
ZABакт. =
![]()
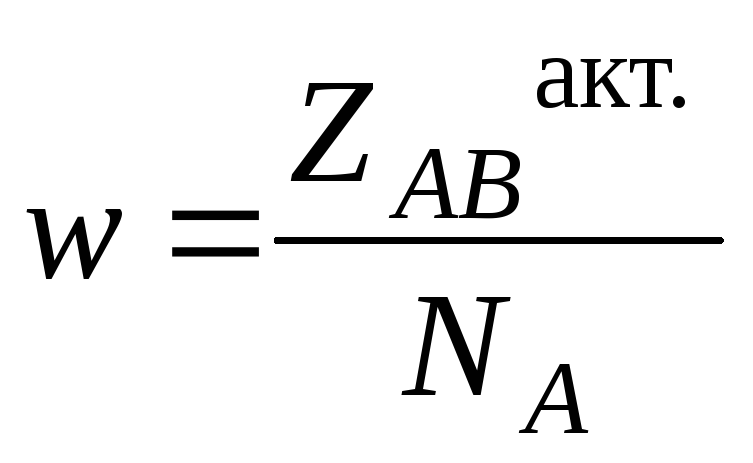 ,
,
где NA - число Авогадро.
![]() ,
,
где
![]() ;
;
![]() .
.
Но формально для реакции А + В = С в соответствии с основным постулатом можно записать
w = k2×CA×CB.
Поэтому можно записать для бимолекулярной реакции
k2(ТАС) =NA![]() ,
,
где
![]() -
число двойных столкновений в 1 см3
при nA
= nB
= 1
-
число двойных столкновений в 1 см3
при nA
= nB
= 1
![]() .
.
Полученное уравнение - это основное уравнение ТАС для константы скорости бимолекулярной реакции. Видно, что оно похоже на уравнение Аррениуса
![]()
Таким образом можно сказать, что предэкспоненциальный множитель А в уравнении Аррениуса можно выразить в виде:
A = NA
P×![]() ,
,
то
есть он учитывает число столкновений
и ориентацию молекул. Но в уравнении
Аррениуса A ¹ f(T),
а в ТАС (NA
P×![]() = f(T)),
так как
= f(T)),
так как
![]() ~ T1/2.
~ T1/2.
В
ТАС с учетом зависимости
![]() от температуры можно записать:
от температуры можно записать:
![]() , (2)
, (2)
где
const×T1/2
= NA
P×![]() .
.
После логарифмирования и дифференцирования уравнения (2) получим:
![]() ; (3)
; (3)
Отсюда можно получить связь истинной (т.е. рассматриваемой в ТАС) и Аррениусовской (классической) энергией активации (Еар.):
![]() - по
Аррениусу (4)
- по
Аррениусу (4)
Сравнивая (3) и (4), получим
ЕТАС = ЕАррениус
-
![]() RT
RT
Основные достоинства теории состоят в том, что показан путь теоретического расчета константы скорости и установлен смысл предэкспоненциального множителя в уравнении Аррениуса.
Однако эта теория содержит и ряд существенных недостатков, обусловленных тем, что она использует упрощенную картину действительных процессов. Главные недостатки теории состоят в том, что она
не позволяет рассчитывать значение энергии активации исходя из параметров молекул реагирующих веществ;
не объясняет влияние на скорость реакции инертных добавок, растворителей и т.д.
