
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
- •11.1 Теория активных столкновений
- •11.2 Теория активированного комплекса
- •11.3 Кинетика гетерогенных химических реакций
- •Отсюда концентрация вещества в приповерхностном слое равна
- •I — кинетическая, II — диффузионная, III — переходная области
- •11.4. Катализ
- •Скорость реакции в целом будет
- •Используя метод стационарных концентраций можно записать
Отсюда концентрация вещества в приповерхностном слое равна
![]() . (11)
. (11)
Подставив выражение (11) в уравнение (10), получим выражение для скорости химической реакции:
![]() , (12)
, (12)
где k1константа скорости реакции в целом (макроскопическая константа скорости реакции).
В стационарных условиях макроскопическая скорость реакции соответствует уравнению реакции первого порядка по концентрации реагирующего вещества.
Очевидно, что
![]() (13)
(13)
Проанализируем уравнение (13).
Если скорость диффузии значительно превосходит скорость собственно химической реакции ( »k), то из уравнения (13) имеем
k1k
т. е. в стационарных условиях скорость всей реакции определяется скоростью собственно химической реакции. Процесс протекает в кинетическойобласти. Энергия активации реакций в этом случае обычно составляет значения более 60 кДж/моль (рис. 3). Значения концентрацийCVиCSмало отличаются друг от друга.
Если скорость собственно химической реакции значительно превышает скорость диффузии, т. е. (k »), то из уравнения (13) имеем
k1.
Лимитирующей стадией процесса в этом случае является диффузия реагирующего вещества к поверхности раздела фаз. Энергия активации в этой области составляет менее 10 кДж/моль. Процесс протекает в диффузионной области.
Существует и переходная область, для которой скорости реакции и диффузии соизмеримы между собой (рис. 3).
Р ис. 3.
Области протекания гетерогенных
химических процессов.
ис. 3.
Области протекания гетерогенных
химических процессов.
I — кинетическая, II — диффузионная, III — переходная области
11.4. Катализ
Основные положения катализа.
Под катализом понимают процесс изменения скорости химической реакции под действием веществ, многократно взаимодействующих с молекулами исходных реагентов с образованием промежуточных продуктов и не расходующихся в реакциях. Эти вещества называют катализаторами.
Катализаторы вступают в реакцию на промежуточных этапах и полностью регенерируются по завершении реакции в неизменном виде.
Явление катализа имеет огромное значение как в природе, так и в химической промышленности. Многие природные процессы протекают под воздействием природных биологических катализаторов ферментов, во много раз превосходящих по активности синтетические неорганические катализаторы. В промышленности, подбирая катализаторы, можно проводить химические процессы в желаемом направлении и с необходимой скоростью. Большое промышленное значение имеют газофазные реакции на твердых катализаторах, например, такие как синтез аммиака из водорода и азота на железных катализаторах, содержащих добавки оксидов некоторых металлов.
Существует положительный (скорость реакции увеличивается) и отрицательный (скорость реакции уменьшается) катализ.
Частным случаем положительного катализа является автокатализ, при котором свойствами катализатора обладает промежуточное соединение или продукты реакции.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе все реагирующие вещества и катализатор находятся в одной фазе, при гетерогенном — катализатор составляет отдельную, обычно твердую, фазу.
Основные положения катализа:
1. Катализатор активно образует промежуточные соединения либо с одним из участников реакции, либо со всеми реагентами.
2. Катализатор в ходе реакции не изменяется химически, и, следовательно, не изменяется rG, то есть катализатор не может вызвать реакцию, которая термодинамически невозможна.
3. Если реакция обратима, то введение катализатора в равной степени ускоряет как прямой, так и обратный процессы. Следовательно, катализатор не смещает положение равновесия и, значит, не увеличивает выход продуктов.
4. В системах, состоящих из веществ, которые могут реагировать с образованием различных продуктов, введение катализатора часто способствует протеканию преимущественно или даже исключительно только одной из возможных реакций. Эта способность катализатора ускорять только одну из нескольких возможных реакций, носит название избирательного или селективного действия. Избирательность катализаторов имеет большое значение при промышленном осуществлении каталитических процессов.
5. При положительном катализе катализатор уменьшает энергию активации реакции. Это связано с тем, что энергии активации образования промежуточных комплексов катализатора с исходными реагентами и образования из них продуктов реакции обычно значительно ниже энергии активации некаталитической реакции.
На рис. 4 представлено изменение энергии системы в каталитической и некаталитической бимолекулярной реакции
А + В С.
В отсутствии катализатора механизм процесса можно представить схемой
A
+ B
![]() [A…B]
С
[A…B]
С
Уменьшение
энергии активации соответствует величине
E
(обычно E 40-60 ![]() )
)
E = Eнекатал. Eкатал. = E0 E1

Рис. 4. Изменение потенциальной энергии в гомогенной каталитической
и некаталитической реакциях.
Предполагают, что в присутствии катализатора (К) эта бимолекулярная реакция протекает в две стадии с образованием промежуточных комплексов АК и АКВ:
1) А + К АК,
2) АК
+ В
![]() АКВ
С
+ К.
АКВ
С
+ К.
Обе стадии каталитической реакции требуют затраты энергии активации Е1 и Е2, однако каждая из этих энергий меньше энергии активации некаталитической реакции.
Гомогенный катализ.
Общую кинетическую схему гомогенного катализа рассмотрим на примере мономолекулярной реакции:
А В
Согласно представлениям теории активированного комплекса, ее механизм описывается следующей схемой:
А
![]() А
В
А
В
При введении катализатора (К) в систему механизм изменяется и происходит образование промежуточного соединения АК
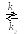
а) А + К АК
б) АК
![]() В
+
К
В
+
К
