
- •Лекция 10 Основные понятия химической кинетики. Кинетика необратимых гомогенных простых реакций. Методы определения порядка реакции. Влияние температуры на скорость реакции. Кинетика сложных реакций.
- •10.1 Основные понятия химической кинетики.
- •Рассмотрим гомогенную реакцию
- •10.2 Кинетика необратимых гомогенных простых реакций.
- •10.3 Кинетика сложных реакций.
- •Обратимые реакции.
- •Параллельные реакции.
- •Последовательные реакции.
- •Понятие о лимитирующей стадии.
- •10.4 Методы определения порядка реакции.
- •10.4 Влияние температуры на скорость реакции.
- •В дифференциальной форме уравнение Аррениуса имеет следующий вид:
10.4 Влияние температуры на скорость реакции.
В большинстве случаев скорость реакции с повышением температуры увеличивается. Если при повышении температуры не меняется механизм реакции, то увеличение скорости реакции определяется увеличением константы скорости реакции.
Для характеристики зависимости скорости химической реакции от температуры было введено понятие температурного коэффициента скорости (γ), равного отношению константы скорости при температуре (Т + 10) к константе скорости при температуре Т (т.е. γ показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов):
![]() .
.
Экспериментально установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость большинства гомогенных реакций в 2 ‑ 4 раза, т. е γ = (2 ‑ 4). Это правило называется правилом Вант–Гоффа.
В общем случае отношение констант скорости реакции k2 и k1, определенных при двух различных температурах Т2 и Т1, равно
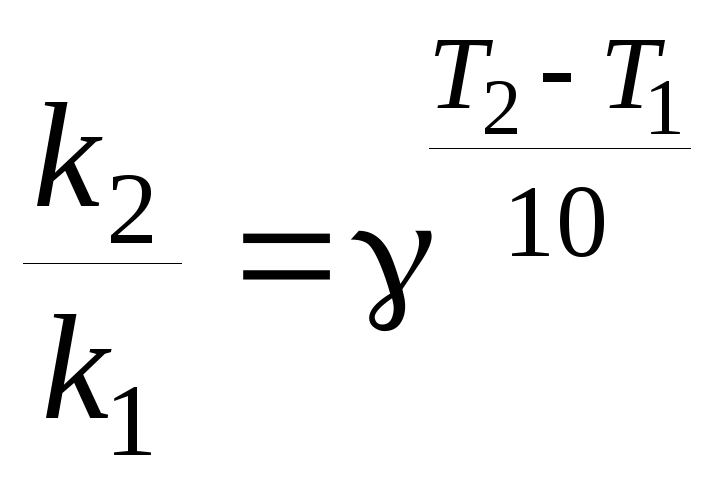 . (22)
. (22)
Однако подобная оценка зависимости скорости реакции от температуры является весьма приближенной. При повышении температуры коэффициент γ не остается постоянным (он уменьшается и при высоких температурах стремится к единице).
Более точную зависимость скорости реакции от температуры дает уравнение Аррениуса.
В дифференциальной форме уравнение Аррениуса имеет следующий вид:
![]() , (23)
, (23)
где k константа скорости реакции,
R универсальная газовая постоянная,
Е энергия активации химической реакции.
В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию.
В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае сложным образом зависит от энергий активации отдельных стадий данной реакции.
Проинтегрировав уравнение (23), получим уравнение Аррениуса в интегральной форме:
![]() , (24)
, (24)
или, если представить постоянную интегрирования как lnA, получим:
![]() ,
,
где А — предэкспоненциальный множитель.
Физический смысл А зависит от типа реакции, например, для мономолекулярных реакций это частота колебаний по разрываемой связи (А 1013 сек1), бимолекулярных величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А 10-10 1011 см3/(мол-л·сек).
Интегрирование уравнения (23) в пределах температур от Т1 до Т2, дает:
![]() . (25)
. (25)
На основании экспериментальных данных энергию активации можно определить как аналитически по уравнению (25), так и графическим методом (см. рис. 12). Если реакция подчиняется уравнению Аррениуса, то зависимость lnk от 1/T должна выражаться прямой линией, что следует из уравнения (24) (рис. 12).
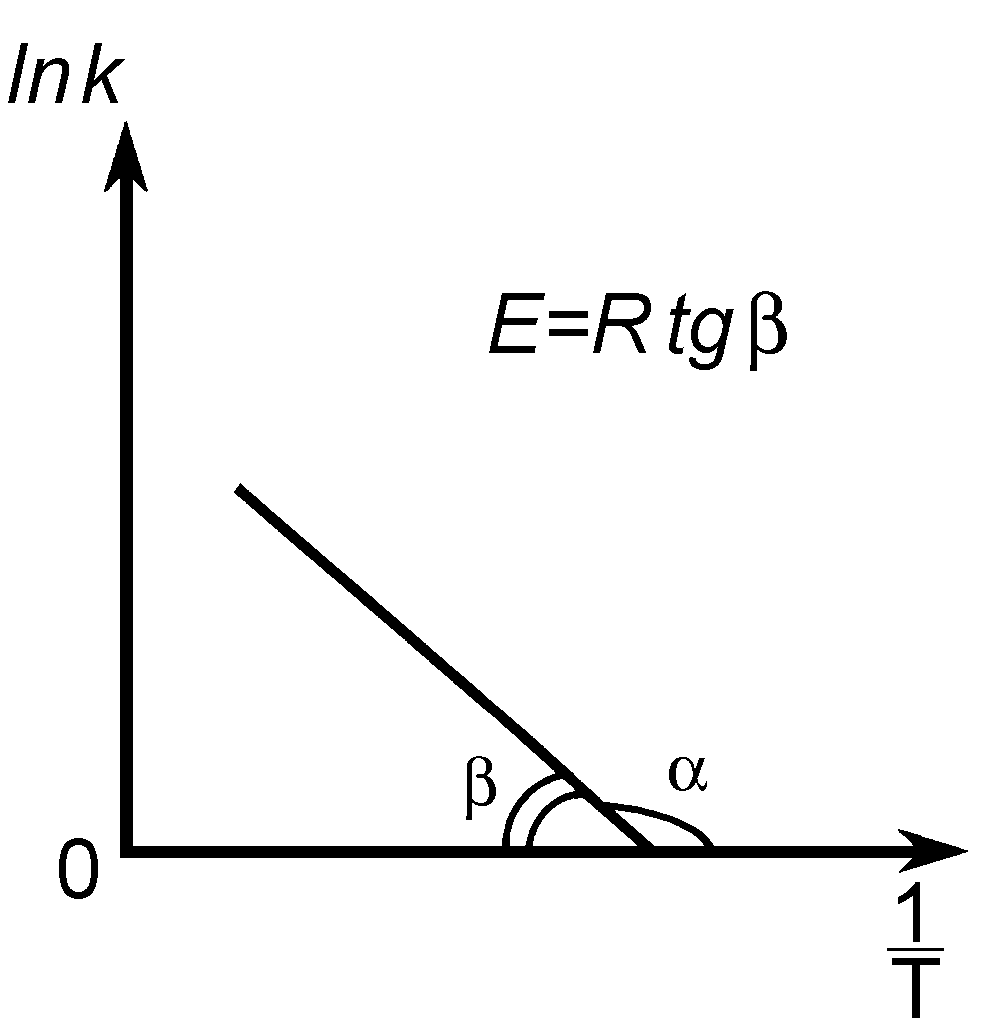
Рис. 12. К расчету энергии активации реакции
по температурной зависимости константы скорости.
Для очень большого числа реакций энергия активации находится в пределах от 60 до 240 кДж/моль, т.е. примерно соответствует энергиям химических связей.
Для реакций с участием активных частиц (свободные атомы, радикалы) энергия активации может быть приблизительно равной нулю.
