
- •Лекция 10 Основные понятия химической кинетики. Кинетика необратимых гомогенных простых реакций. Методы определения порядка реакции. Влияние температуры на скорость реакции. Кинетика сложных реакций.
- •10.1 Основные понятия химической кинетики.
- •Рассмотрим гомогенную реакцию
- •10.2 Кинетика необратимых гомогенных простых реакций.
- •10.3 Кинетика сложных реакций.
- •Обратимые реакции.
- •Параллельные реакции.
- •Последовательные реакции.
- •Понятие о лимитирующей стадии.
- •10.4 Методы определения порядка реакции.
- •10.4 Влияние температуры на скорость реакции.
- •В дифференциальной форме уравнение Аррениуса имеет следующий вид:
10.3 Кинетика сложных реакций.
В отличие от простых (одностадийных) реакций, механизм которых совпадает со стехиометрическим уравнением реакции, подавляющее большинство химических реакций является сложными, т.е. протекает через ряд последовательных и (или) параллельных стадий, при этом некоторые стадии протекают с участием промежуточных веществ, не являющихся ни исходными веществами, ни продуктами реакции. То есть в случае сложных реакций в системе протекают две или большее количество реакций.
В основе описание кинетики сложных реакций лежат: а) принцип независимости протекания реакций, б) принцип лимитирующей стадии.
Согласно принципу независимости протекания реакций “если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна произведению концентраций реагирующих веществ”.
Однако принцип независимости протекания реакций не является таким же общим положением как основной постулат химической кинетики. Он не применим, например, к сопряженным реакциям.
Рассмотрим некоторые сложные реакции.
Обратимые реакции.
Обратимыми называются реакции, в которых наряду с превращением исходных веществ в продукты протекает с заметной скоростью и противоположно направленная реакция превращения продуктов в исходные вещества.
В системах, в которых протекают такие реакции, через некоторое время достигается состояние химического равновесия.
О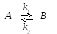 братимые
реакции – это реакции типа:
братимые
реакции – это реакции типа:
Простейший случай это реакция первого порядка.
Реакция идет до установления равновесия, при котором
wпрямой = wобр.,т.е. k1CA = k2CB
В состоянии равновесия
![]() =kравн.
=kравн.
Поскольку вещество А расходуется в прямой реакции и образуется в обратной, то суммарная скорость по изменению концентрации вещества А со временем описывается следующим уравнением
![]() , (16)
, (16)
где w1 и w2 скорости прямой и обратной реакций, соответственно;
С0А начальная концентрация вещества А (начальная концентрация вещества В принята равной нулю);
СА и СВ текущие концентрации веществ А и В в момент времени t (рис. 6).
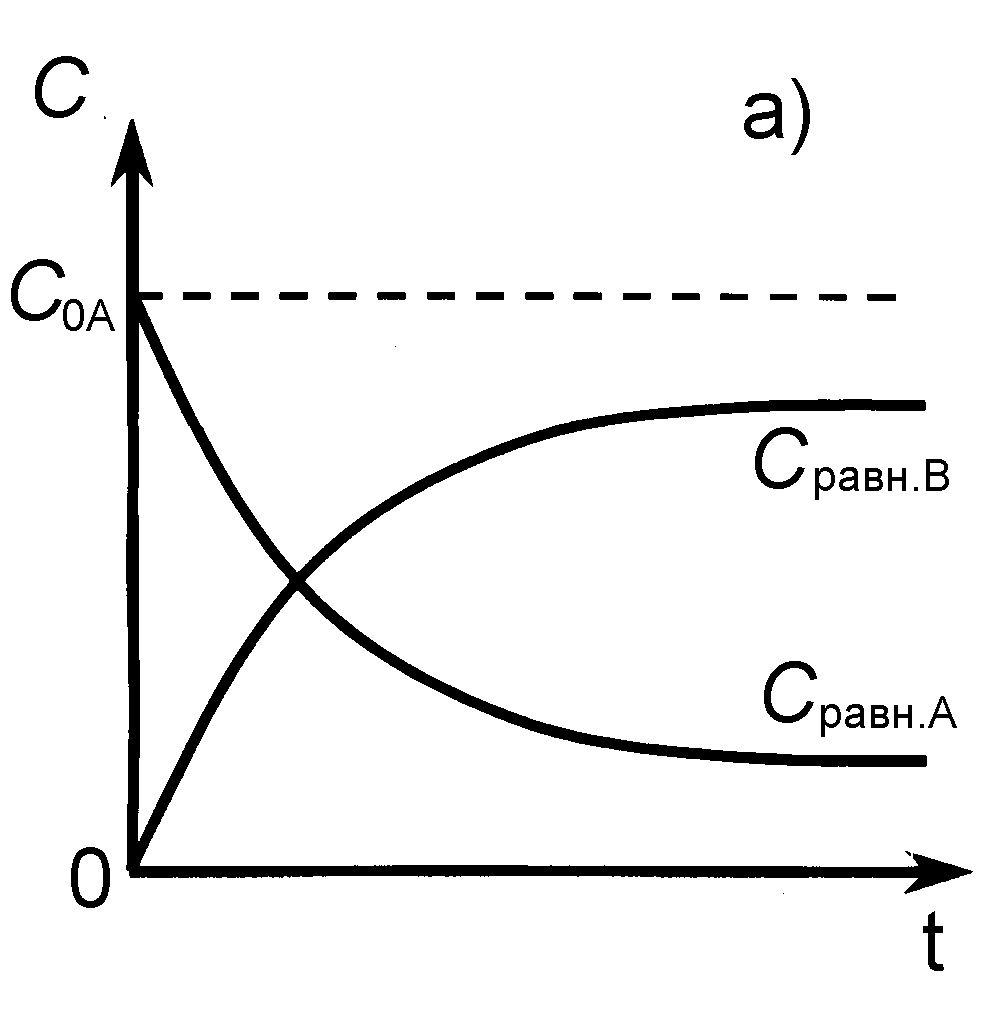
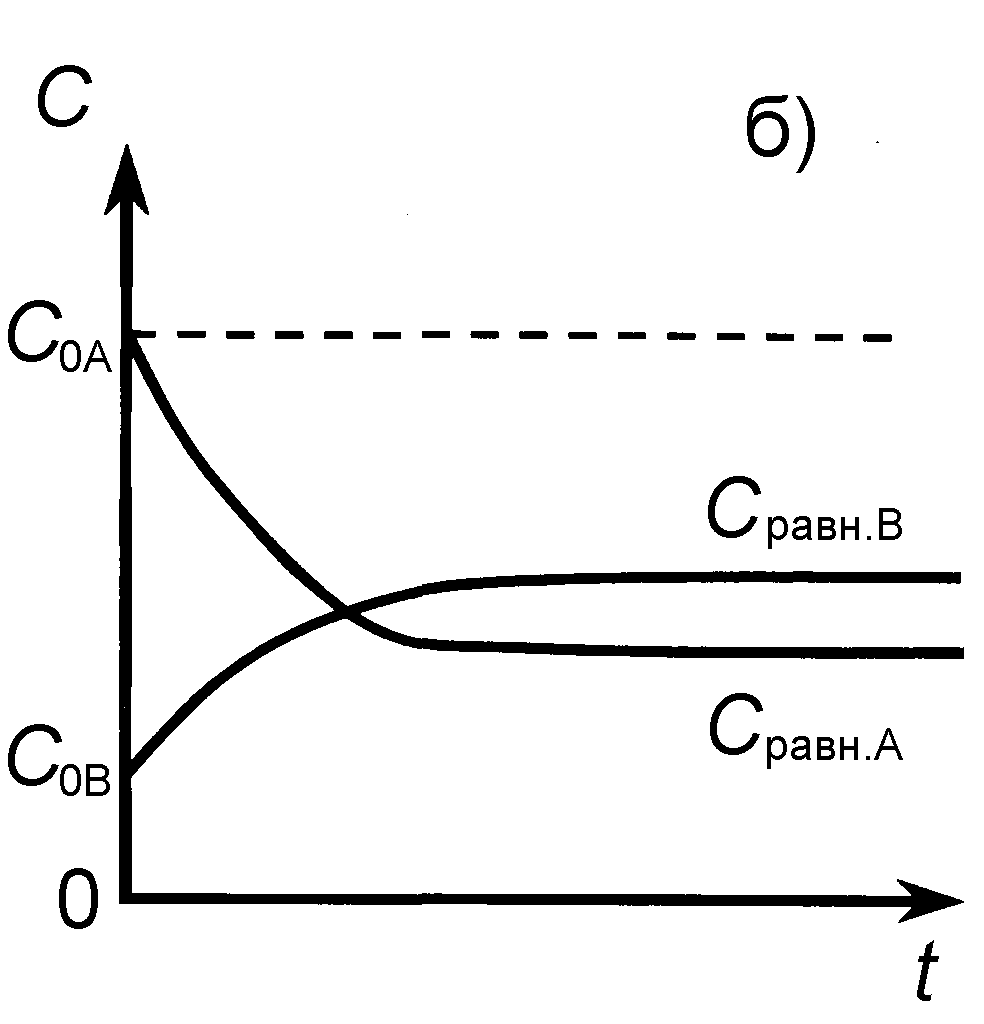
Рис. 6. Кинетические кривые для обратимой реакции
а) С0В = 0, б) С0В 0.
Параллельные реакции.
Параллельными называют реакции, в которых одни и те же исходные вещества реагируют одновременно в двух или более направлениях.
В простейшем случае это реакции типа
В
![]() А
А
![]() С.
С.
Обе реакции являются необратимыми реакциями первого порядка. Суммарная скорость расходования вещества А равна
![]() =
w1
+ w2
= k1CA
+ k2CA
= (k1
+ k2)CA, (17)
=
w1
+ w2
= k1CA
+ k2CA
= (k1
+ k2)CA, (17)
где w1 и w2 скорости превращения вещества А в вещества В и С, соответственно.
После интегрирования уравнения (17) получаем
![]() . (18)
. (18)
По уравнению (18) можно рассчитать сумму констант (k1 + k2). Чтобы разделить эту сумму на отдельные составляющие, необходимо использовать еще одно уравнение, дающее отношение констант в некоторый момент времени t. Очевидно, что в любой момент времени
![]() , (19)
, (19)
где CB и CC текущие концентрации веществ В и С. Решая систему уравнений (18) и (19), можно найти значения констант скорости по отдельности.
Кинетические кривые для рассматриваемого случая показаны на рис. 7.
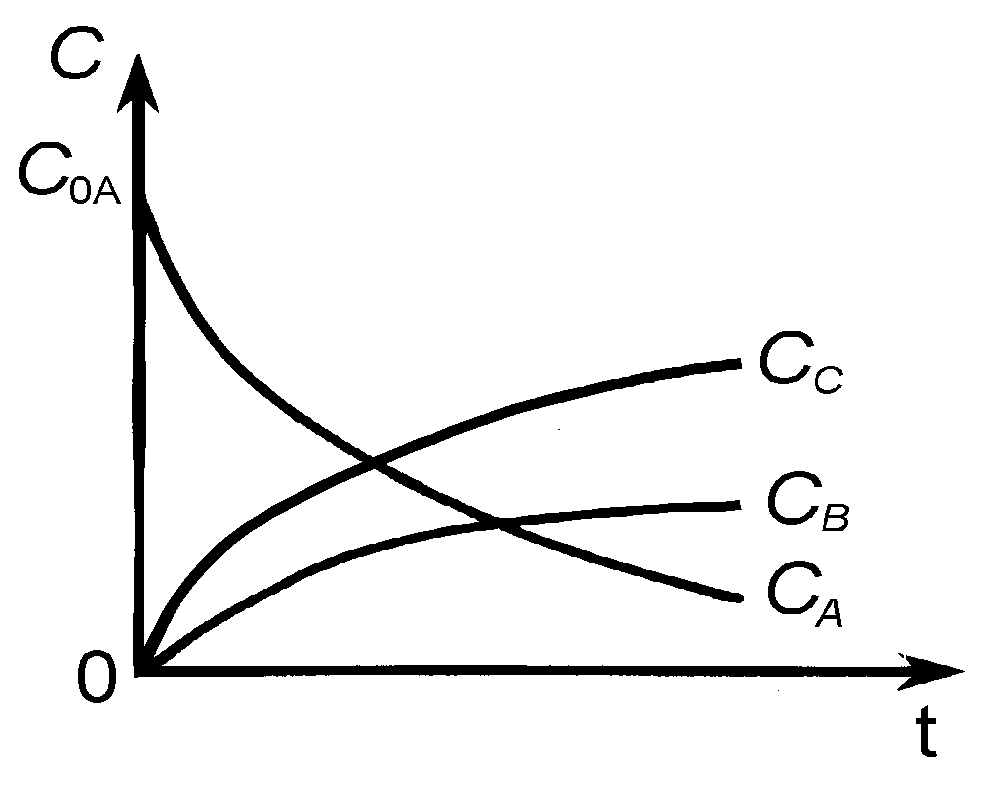
Рис. 7.
