
- •Лекция 10 Основные понятия химической кинетики. Кинетика необратимых гомогенных простых реакций. Методы определения порядка реакции. Влияние температуры на скорость реакции. Кинетика сложных реакций.
- •10.1 Основные понятия химической кинетики.
- •Рассмотрим гомогенную реакцию
- •10.2 Кинетика необратимых гомогенных простых реакций.
- •10.3 Кинетика сложных реакций.
- •Обратимые реакции.
- •Параллельные реакции.
- •Последовательные реакции.
- •Понятие о лимитирующей стадии.
- •10.4 Методы определения порядка реакции.
- •10.4 Влияние температуры на скорость реакции.
- •В дифференциальной форме уравнение Аррениуса имеет следующий вид:
Последовательные реакции.
К последовательным реакциям относят реакции типа:
А
![]() В
В
![]() С.
С.
Вещество В образуется из А (константа k1) и расходуется на образование С (константа k2), обе реакции являются необратимыми реакциями первого порядка.
Рассматриваемая реакция является двухстадийной с образованием промежуточного соединения.
Скорость первой стадии w1 = k1CA, скорость второй стадии w2 = k2CB.
Скорость реакции можно выразить через изменение концентраций всех участников реакции:
![]()
![]()
![]()
Кинетические кривые для рассматриваемого случая показаны на рис. 8.
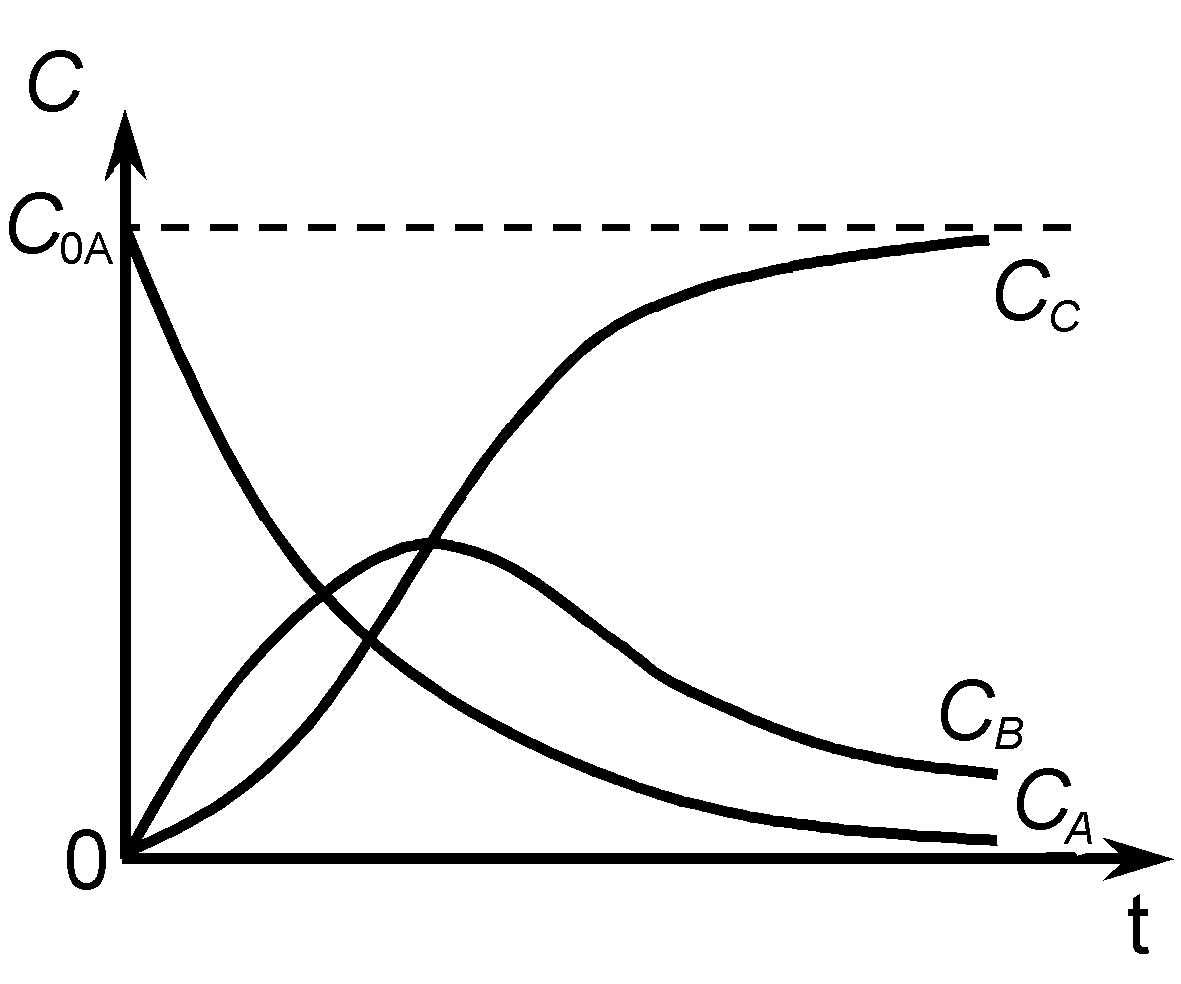
Рис. 8.
Скорость всего процесса будет определяться лимитирующей стадией сложной реакции. Положение максимума на кривой «CB» (и точки перегиба на кривой «CC») определяются соотношением величин k1 и k2.
а) если k1 k2, промежуточный продукт B будет устойчив и может быть достигнута концентрация CB, соизмеримая с CA; продукт С образуется с малой скоростью.
б) если k2 k1, промежуточный продукт B неустойчив, его концентрация CB мала, но высока скорость образования продукта С.
Понятие о лимитирующей стадии.
Нередко скорость сложной химической реакции может зависеть только от скорости одной из ее стадий. Эту стадию называют лимитирующей (т. е. определяющей скорость всей реакции в целом).
Принцип лимитирующей стадии скорость последовательной реакции определяется скоростью наиболее медленной стадии, суммарная скорость параллельных реакций определяется скоростью наиболее быстрой стадии.
10.4 Методы определения порядка реакции.
На
практике исследование скорости химических
реакций начинают с определения порядков
этой реакции по каждому из реагирующих
веществ и (или) порядка реакции в целом.
Для реакции с участием нескольких
веществ определить
![]() можно только поэтапно, определяя порядки
по отдельным веществам. Для этого
используется метод избытка (метод
изоляции, метод Оствальда), а затем
определяютni
любым из описанных ниже методов.
можно только поэтапно, определяя порядки
по отдельным веществам. Для этого
используется метод избытка (метод
изоляции, метод Оствальда), а затем
определяютni
любым из описанных ниже методов.
Метод изоляции или метод избытка.
Если
в исследуемой реакции участвуют несколько
реагирующих веществ, то общий порядок
реакции
![]() ,
гдеni
порядок по каждому из участников. Частный
порядок ni
можно определить, взяв все вещества,
кроме данного, взять в большом избытке.
Так, в случае реакции
,
гдеni
порядок по каждому из участников. Частный
порядок ni
можно определить, взяв все вещества,
кроме данного, взять в большом избытке.
Так, в случае реакции
А + В + С D
скорость равна
![]() .
.
Если вещества В и С взяты в большом избытке, то при протекании реакции их концентрации практически не изменяются, т.е.
![]() .
.
И
![]() .
.
Тогда, определив порядки реакции по каждому из реагирующих веществ, можно найти общий порядок реакции:
n = n1 + n2 + n3.
Метод подстановки.
Этот метод заключается в том, что опытные результаты текущие концентрации веществ в моменты времени t последовательно подставляются в интегральные кинетические уравнения реакций нулевого (7), первого (9), второго (12 или 14) порядков и определяется, какое из уравнений дает практически постоянную величину константы скорости. Именно это уравнение и определяет порядок исследуемой реакции.
Графический вариант метода подстановки.
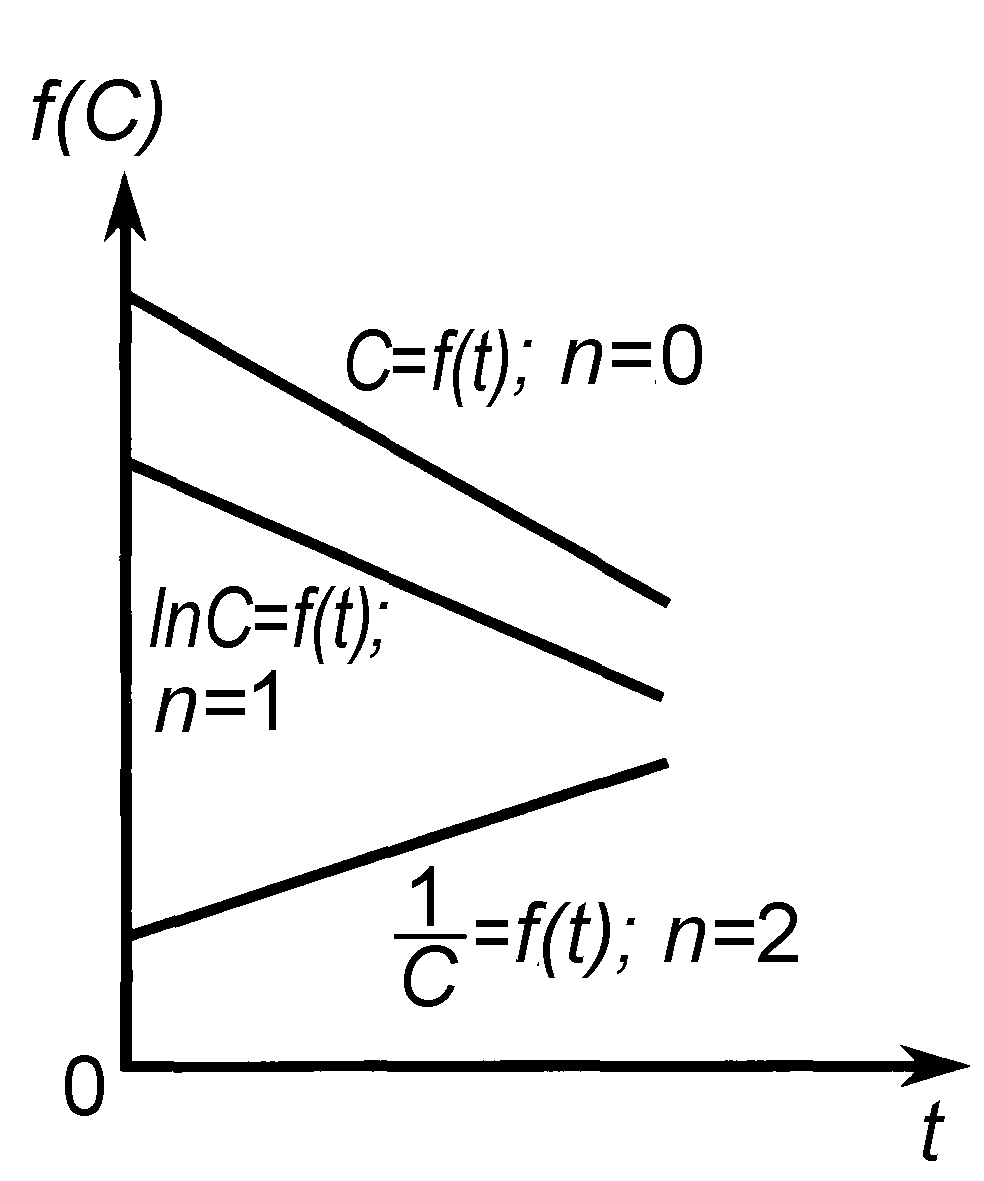
|
Рис. 9. Линейные зависимости различных функций концентрации реагирующих веществ от времени. |
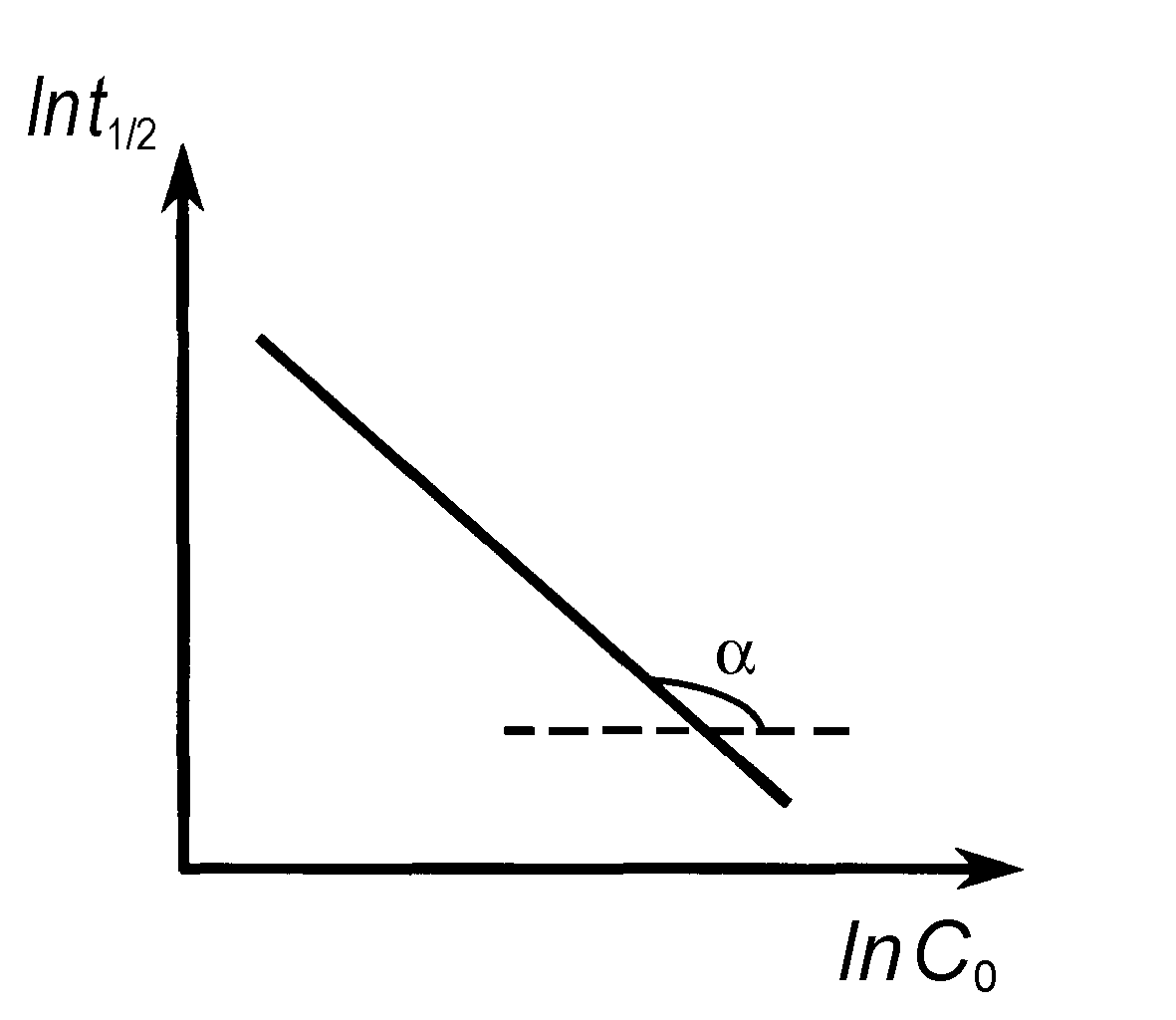
Рис. 10. Определение порядка реакции по зависимости времени полупревращения от начальной концентрации |
Графический метод состоит в построении зависимостей различных функций концентрации от времени и определения, для какой из них наблюдается прямолинейная зависимость.
Линейные зависимости для реакций различных порядков получаются в следующих координатах (рис. 9): нулевого порядка С = f (t), первого порядка lnС = f (t), второго порядка 1/С = f (t).
Для
реакций более высоких порядков выбираются
координаты
![]() t.
t.
Метод определения порядка реакции по времени полупревращения.
Порядок реакции определяется на основе опытной зависимости времен полупревращения (t1/2) от начальных концентраций веществ (C0).
Как уже отмечалось, для n = 0 время полупревращения прямо пропорционально величине С0, для n = 1 не зависит от С0, а n = 2 обратно пропорционально С0. Для реакции любого другого порядка справедливо соотношение (20)
![]() , (20)
, (20)
где t1/2(1) и t1/2(2) время полупревращения при начальных концентрациях С01 и С02, соответственно.
Возможен графический вариант метода: по оси ординат откладываются значения ln(t1/2), а по оси абсцисс значения lnC0 (рис. 10), тогда n = tg + 1.
Дифференциальный метод Вант-Гоффа.
Этот метод применяют, когда в реакции участвует одно вещество, или при участии нескольких веществ, когда все вещества, кроме данного (А), взяты в большом избытке. Тогда скорость реакции равна
![]() . (21)
. (21)
Прологарифмируем уравнение (21):
lnw
= lnk
+ n
lnС![]()
Очевидно, что в координатах lnw lnCмы получим линейную зависимость, причемn = tg.
Построив зависимость lnw от lnC (рис. 11), можно определить порядок реакции, равный в данном случае тангенсу угла наклона прямой (n = tg).
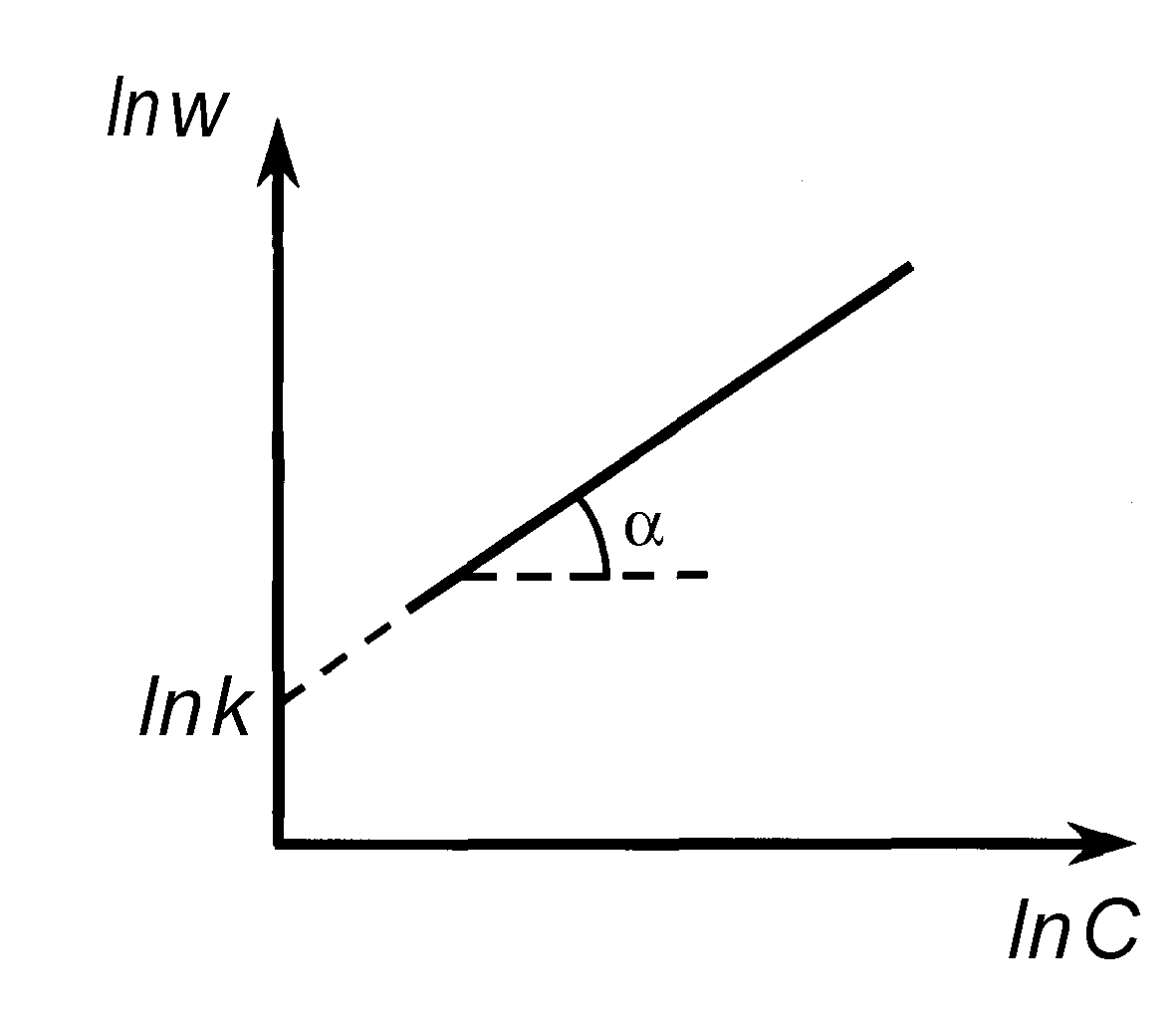
Рис. 11. Определение порядка реакции дифференциальным методом Вант-Гоффа.
