
- •1. Элементарная ячейка
- •2. Основные типы кристаллических решеток
- •3. Кристаллографические плоскости и направления
- •4. Индексы Миллера
- •5. Решетка Бравэ
- •6. Кристаллические системы (сингонии)
- •7. Точечные дефекты. Равновесная концентрация вакансий
- •8. Краевые и винтовые дислокации
- •9. Зависимость плотности дислокаций от степени деформации
- •10. Вектор Бюргерса
- •11. Источники Франка-Рида
- •12. Границы зерен (наклона, кручения, специальные)
- •13. Методы определения разориентировок
- •14. Особенности спектра разориентирок в умз материалах
- •15. Объемные дефекты
- •16. Природа рентгеновских лучей (открытие рентгеновских лучей, возможности рса)
- •17. Формула Вульфа-Брэгга
- •18. Свойства рентгеновского излучения (длина волны и энергия рентгеновского излучения)
- •19. Спектр рентгеновского излучения
- •20. Закон Мозли
- •21. Получение рентгеновского излучения (рентгеновские трубки)
- •22. Метод Лауэ
- •23. Метод вращающегося кристалла
- •24. Метод Дебая-Шерера
- •25. Различия в рентгенограммах нанокристаллического и крупнозернистого образцов
- •26. Анализ уширения рентгеновских пиков
- •27. Различие в размере кристаллитов определяемом методами рса и пэм
- •28. Типичные значения окр, микроискажений кристаллической решетки и плотности дислокаций в никеле подвергнутом ипдк и ркуп
- •29. Взаимодействие электронов с веществом
- •30. Длина волны электронов для ускоряющих напряжений 100кВ, 200кВ
- •31. Устройство электромагнитной линзы, количество линз в современных пэм.
- •32. Функции линз в просвечивающем электронном микроскопе.
- •33. Закон Ричардсона
- •34. Устройство электронной пушки (из 33 взять начало)
- •35. Типы катодов применяемых в электронных микроскопах
- •36. Сферическая аберрация
- •37. Хроматическая аберрация
- •38. Астигматизм
- •39. Критерий Рэлея
- •40. Разрешающая способность электронного микроскопа
- •41. Виды изображений в электронном микроскопе
- •42. Толщинные контура экстинкции. Определение толщины фольги.
- •43. Изгибные контура экстинкции
- •44. Муаровы узоры
- •45. Кикучи-линии
- •46. Контраст на изображении дислокаций
- •47. Определение межплоскостных расстояний по электронограмме
- •48. Какую информацию можно извлечь из анализа дифракционных картин
1. Элементарная ячейка
Элементарные ячейки представляют собой геометрические фигуры, содержащие изображение атомов, перемещением которых можно воспроизвести кристаллическую решетку всего кристалла в целом. При этом атомы в узлах элементарной ячейки, часто представляют в виде точек различного диаметра, тогда как в действительности они имеют определенный атомный радиус, вследствие которого могут быть представлены в виде соприкасающихся шаров.
Элементарную ячейку одного и того же кристалла можно выбрать различными способами. В частности все пространство кристалла можно заполнить ячейками с минимальным объемом. Такие ячейки называются примитивными элементарными ячейками.
В физическом металловедении при рассмотрении структуры металлов обычно используют понятие условной элементарной ячейки, которая имеет размер больше чем примитивная ячейка, но в тоже время нагляднее отражает симметрию кристаллической решетки.
Всегда можно выбрать такую примитивную ячейку, которая обладала бы полной симметрией относительно кристаллической решетки. Наиболее известным примером такого выбора является ячейка Вигнера-Зейтца.
Для
построения ячейки Вигнера-Зейтца с
центром в некоторой исходной точке
нужно провести прямые, соединяющие эту
точку со всеми другими точками решетки,
после чего построить плоскости,
перпендикулярные к этим прямым и делящие
их пополам, и выбрать наименьший
многогранник, ограниченный построенными
плоскостями и содержащий исходную
точку. Полученная таким образом ячейка
Вигнера-Зейтца для объемно-центрированной
кубической решетки имеет вид усеченного
октаэдра.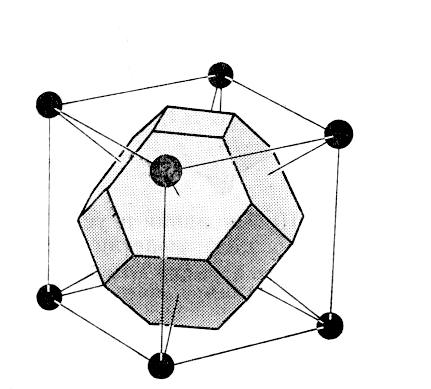
2. Основные типы кристаллических решеток
Для металлов наиболее распространенными являются три основных типа кристаллической решетки: объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
В ГЦК решетке атомы расположены в вершинах куба и в центре каждой грани. Эту упаковку имеют следующие металлы: Cu, Al, Ni, g-Fe и другие.
В ОЦК решетке атомы расположены в вершинах куба, а один атом - в центре его объема. Эта решетка характерна для Mo, W, Ta, Nb, V, a-Fe и других металлов.
В ГПУ решетке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома - в средней плоскости призмы. Эту решетку имеют Mg, a-Ti, Zn, Cd и другие металлы.

Расстояние а между атомами по ребру элементарной ячейки называется параметром или постоянной решетки.
Важной характеристикой является координационное число, которое представляет собой число атомов находящихся на равном и наименьшем расстоянии от данного атома.
В кубической объемно-центрированной решетке на равном и ближайшем расстоянии от центрального атома находится 8 атомов, расположенных в вершинах куба. То есть, координационное число для этой решетки равно 8. Для гранецентрированной кубической и гексагональной плотноупакованной решеток координационное число составляет величину равную 12.
В кристаллической решетке атомы имеют различную плотность упаковки в разных направлениях, вследствие которого появляется зависимость свойств кристалла от направления. Такое явление, когда свойства вещества зависят от направления, называется анизотропией.
