
- •I. Волновые свойства электрона и атомные спектры
- •1.2.Примеры решения задач
- •2. Квантовые числа. Принцип паули. Принцип наименьшей энергии. Электронные формулы. Правило хунда
- •2.2. Распределение электронов в многоэлектронном атоме Принцип наименьшей энергии (правила Клечковского)
- •2.3. Изображение электронных формул атомов.
- •3. Периодическая система, периодический закон д.И.Менделеева, периодичность изменения свойств элементов
- •3.1. Примеры решения задач
- •4. Химическая связь
- •4.2. Свойства ковалентной связи
- •4.3 Гибридизация атомных орбиталей
- •4.4. Межмолекулярное взаимодействие
- •5. Примеры решения задач
- •6. Требования к знаниям и рекомендации
- •7. Задачи для самостоятельного контрольного решения
- •Периодическая система элементов д.И.Менделеева
- •*Лантаноиды
- •**Актаноиды
- •Строение атома. Периодический закон и периодическая система д.И. Менделеева. Химическая связь
- •450062, Республика Башкортостан, г.Уфа, Космонавтов, 1
4. Химическая связь
Природа химической связи электрическая
В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи; ковалентную, ионную, металлическую.
Главную роль в межатомных взаимодействиях играют те электроны, которые связаны в атоме наименее прочно. Эти электроны обусловливают возникновение химических (валентных) связей между атомами при образовании молекул. Их называют валентными.
Квантово-механические расчеты показывают, что взаимодействовать (вступать в связь) могут только те атомы, у которых имеются неспаренные электроны.
Если в нормальном состоянии (невозбужденном) на внешнем уровне атома нет спаренных электронов, то при затрате сравнительно небольшой энергии извне в пределах одного и того же уровня происходит процесс разъединения электронной пары. Например, возбуждение может произойти из s- состояния в р-состояние, из р- в d- состояние.
Нормальное состояние Возбужденное состояние
4Ве
1s22s2 4Ве*
1s22s12p1
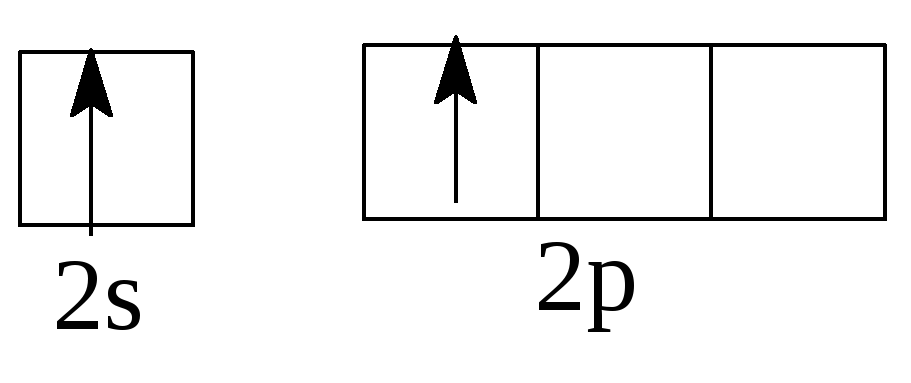
17CI ls22s22p63s23p5 C1* 3 2Зр43d1 число непарных
электронов – 3
Для атома хлора возможны следующие возбуждения
Нормальное
состояние:
Первое
возбужденное
состояние,
число
непарных электронов -3


Второе
возбужденное состояние, число
непарных электронов-5

3s23р33d2
Третье
возбужденное состояние, число непарных
электронов-7

3s13р33d3
Способность каждого элемента к образованию химических связей называется валентностью. Валентность хлора в нормальном состоянии равна 1, при С1*- 3, при Cl** - 5, при Cl*** - 7. Химическая связь в основном осуществляется так называемыми валентными электронами. У s- и р-элементов валентными являются электроны внешнего слоя, а у d-элементов - электроны s -состояния внешнего слоя и d- состояния предвнешнего слоя.
4.1. Ковалентная связь
Ковалентная связь сосредоточена между двумя атомами, она двухцентровая, двухэлектронная и осуществляется одной или несколькими общими электронными парами.
Ковалентная связь может образоваться по обменному и донорно-акцепторному механизмам.
Обменный
механизм: электронные облака непарных
электронов, взаимно перекрывая друг
друга, образуют общие электронные облака
(молекулярные) с более высокой электронной
плотностью, например, Сl2,
N2,
H2O,
HCI.
Например, при образовании молекул Cl2,
N2
образуются общие электронные облака
(одно, три), симметрично располагающиеся
в пространстве относительно обоих ядер
атомов, связь неполярна. ![]()
В
случае образования молекул HCl,
H2O
и других общие электронные облака
несимметричны и смещены к более
электроотрицательному элементу Cl,
0; связь полярна. ![]()
Электронные облака атомов, как показано ниже, имеют различную форму (см. 2.1), поэтому их взаимное перекрывание может осуществляться разными способами.
Р
:

π-связь образуется за счет взаимного перекрывания электронных облаков перпендикулярно линии соединения центров ядер (σ).
:
К ним относятся связи πp-p; πd-d; πd-f; πf-f .S-орбитали не принимают участия в образовании π-связи, δ(дельта)-связи встречаются в соединениях между атомами переходных элементов, например в ионе (Re2Cl8)2-.
:
На этом рисунке приведены схемы перекрывания двух атомных d-орбиталей, расположенных в параллельных плоскостях.
Донорно-акцепторный механизм (ДАМ). В этом случае различают атом-донор, представляющий при образовании связи двухэлектронное облако, и атом-акцептор: имеющий свободную орбиталь.
Рассмотрим образование иона NH4+ из молекулы аммиака и -катиона водорода, имеющего свободную орбиталь. Атом азота в молекуле аммиака имеет неподеленную 2s-электронную пару (донор), а катион водорода - свободную орбиталь (акцептор):

В
ионе аммония атом азота образует три
ковалентных N-Н-связи
путем перекрывания 3 одноэлектронных
р - облаков азота с 3 электронами 3 атомов
водорода, а четвертая N-Н
связь образуется по ДАМ. Ковалентную
связь, образованную по ДАМ,условно
обозначают стрелкой (![]() ).
).
