- •I. Волновые свойства электрона и атомные спектры
- •1.2.Примеры решения задач
- •2. Квантовые числа. Принцип паули. Принцип наименьшей энергии. Электронные формулы. Правило хунда
- •2.2. Распределение электронов в многоэлектронном атоме Принцип наименьшей энергии (правила Клечковского)
- •2.3. Изображение электронных формул атомов.
- •3. Периодическая система, периодический закон д.И.Менделеева, периодичность изменения свойств элементов
- •3.1. Примеры решения задач
- •4. Химическая связь
- •4.2. Свойства ковалентной связи
- •4.3 Гибридизация атомных орбиталей
- •4.4. Межмолекулярное взаимодействие
- •5. Примеры решения задач
- •6. Требования к знаниям и рекомендации
- •7. Задачи для самостоятельного контрольного решения
- •Периодическая система элементов д.И.Менделеева
- •*Лантаноиды
- •**Актаноиды
- •Строение атома. Периодический закон и периодическая система д.И. Менделеева. Химическая связь
- •450062, Республика Башкортостан, г.Уфа, Космонавтов, 1
2.2. Распределение электронов в многоэлектронном атоме Принцип наименьшей энергии (правила Клечковского)
Для решения вопроса о распределении электронов в атоме, кроме обязательного учета принципа Паули, необходимо обязательно придерживаться принципа наименьшей энергии, формулировка его такова: в нормальном состоянии атома каждый электрон занимает то состояние из всех возможных, в котором он обладает наименьшей энергией (следовательно, наиболее прочной связью с ядром). Поэтому электрону необязательно занимать вышележащий энергетический уровень, если в нижележащем уровне есть места, располагаясь на которых электрон будет обладать меньшей энергией. Так как энергия электрона определяется значениями суммы главного (n) и орбитального (l) квантовых чисел (n + l), то АО заполняются в порядке последовательного возрастания их энергий и определяются двумя правилами Клечковского. Согласно этим правилам АО орбитали заполняются электронами в порядке последовательного увеличения суммы (n + l) (от меньшей суммы к большей) - (1-е правило Клечковского), а при одинаковых значениях суммы (n + l) у нескольких периодов заполнение подуровней происходит от меньшего значения n к большему значению l (2-e правило Клечковского).
Последовательность заполнения электронами энергетических уровней и подуровней в порядке возрастания их энергий имеет вид 1s<2s<2p<3s<3p<4s≈3d≈4s<4p<5s≈4d<5p<6s<4f≈5d<6p<7s<5f≈6d<7p.
2.3. Изображение электронных формул атомов.
Правило Хунда
Последовательность
заполнения АО электронами в пределах
одного энергетического подуровня
такова, что сначала в каждой энергетической
ячейке, если она по энергетическим
условиям начинает заполняться электронами,
будет по одному "холостому"
неспаренному электрону, а затем по мере
увеличения числа электронов в оболочке
(с условием структуры атомов), в каждую
ячейку поступает еще по одному электрону
с направлением спина, противоположным
спину первого электрона. Абсолютное
значение суммарного спина электрона в
пределах данного подуровня должно быть
максимальным (правило Хунда), при любом
другом размещении атом будет находиться
в возбужденном состоянии, т.е. будет
характеризоваться более высокой
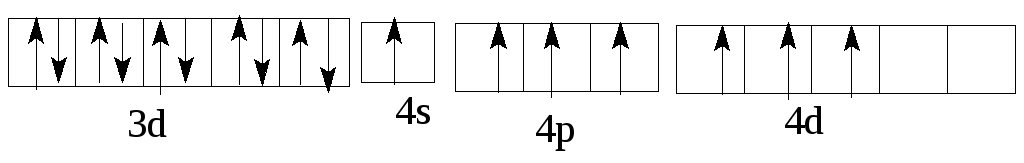
энергией. Так, если в пяти d
–ячейках на d-подуровне
надо распределить 5 электронов, то они
будут располагаться каждый в отдельной
ячейке, а именно![]() ,а
не так:
,а
не так: ![]()
2.4. Примеры решения задач
Задача 1. Определите, сколько подуровней и орбиталей может быть в 5-м
энергетическом уровне.
Решение. Число подуровней определяется орбитальным квантовым
числом l , которое принимает значение от 0 до (n-1). Если n=5, то l=0,1,2,3,4. Число подуровней на 5 уровне равно 5.
Известно, что ориентацию орбиталей в пространстве и
возможное число орбиталей характеризует магнитное
квантовое число ml, которое принимает значение от –l,0,+l.
В данной задаче l = 0, 1, 2, 3, 4. Если l = 0(s), ml = 0, это значит, что в
случае орбитали шаровой симметрии возможна только одна ее ориентация, т.е. число орбиталей равно 1; если l = 1(p), то ml принимает значения –l,0,+1, т.е. число орбиталей на р-подуровне равно 3; l=2, то ml принимает значения от -2,-1,0,1,2, т.е. число орбиталей нa d-подуровне равно 5; ml=3(f), ml принимает значения от -3,-2,-1,0,1,2,3, т.е. число орбиталей на f подуровне равно 7; ml =4(g), ml принимает значения -4,-3,-2,-1,0,1,2,3,4, т.е. возможное число орбиталей на g-подуровне равно 9. Таким образом, максимально возможное число орбиталей на 5 уровне равно 1+3+5+7+9=25.
Задача 2. Написать электронные формулы атомов йода и вольфрама.
Решение. Для распределения электронов в многоэлектронном атоме воспользуемся принципом Паули и правилами Клечковского.
Энергия электрона в атоме определяется значением (n+l) –суммой главного и орбитального квантовых чисел, последовательность заполнения электронами отдельных подуровней происходит в порядке последовательного увеличения суммы (n+l) (1-е правило Клечковского), а при одинаковых значениях суммы - в порядке последовательного возрастания главного квантового числа - (2-е правило Клечковского). Атом иода находится в 5-м периоде, порядковый номер 53. Для распределения электронов предварительно можно для каждого уровня написать значения подуровней и (n+l) (см. таблицу). Заполнение ведем согласно 1-му правилу Клечковского, а с четвертого уровня прибегаем ко 2-му правилу, т.е. если у 2-х квантовых слоев, как у нас, n=3 и n =4, сумма (n+l) равна 4 - (3+1) и (4+0), то после суммы (3+1), заполняется сумма(4+0). Далее заполняем сумму 5, которая повторяется в 3-х квантовых слоях 3,4,5 (3+2, 4+1, 5+0). В этом случае вначале заполняем сумму от меньшего n к большему l, т.е. 3d, 4р, 5s по принципу наименьшей энергии, следующая возрастающая сумма (n+l)=6, она наблюдается также в 3-х квантовых слоях (4+2, 5+1, 6+0). Таким образом распределим 53 электрона атома йода по 2-м квантовым числам 1s2, 2s2, 2p6, 3s2, Зр6, 4s2, 3d10, 4p6,5s2,4d10, 5p5.
|
Номер периода |
n=1 |
n=2 |
n=3 |
n=4 |
n=5 |
n=6 |
|
Значе-ние l |
l=0(s) |
l=0(s), 1(p) |
l=0(s), 1(p),2(d) |
l=0(s),1(p),2(d),3f |
l=0(s),1(p),2(d),3f,4d |
l=0(s), 1(p),2(d), 3f,4d,5(… |
|
Сумма |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
(n+l) |
|
|
1+0(s)=1 |
2+0(s)=2 |
3+0(s)=3 |
4+0(s)=4 |
5+0(s)=5 |
6+0(s)=6 |
|
|
|
2+1(p)=3 |
3+1(p)=4 |
4+1(p)=5 |
5+1(p)=6 |
6+1(p)=7 |
|
|
|
|
3+2(d)=5 |
4+2(d)=6 |
5+2(d)=7 |
6+2(d)=8 |
|
|
|
|
|
4+3(f)=7 |
5+3(f)=8 |
6+3(f)=9 |
|
|
|
|
|
|
5+4(q)=9 |
|
Атом вольфрама находится в 6-м периоде, порядковый номер 74; распределим электроны аналогично атому йода:
1s2,2s2,2p6,3s2,3р6,4s2,3d10,4р6,5s2,4dI0,5p6,6s2 ,4f14,5d4.
Задача 3. Определить последовательность заполнения электронами
подуровней в атомах элементов, если их суммы (n+l)
соответственно равны 5 и 6.
Решение. n+l =5 n+l=6
n=3, n=4,
l=2, l=1, l=0 l=3, l=2, l=1, l=0
n=4, n=5,
l=3, l=2, l=1 l=0 l=4, l=3, l=2, l=1 l=0
n=5 n =6
l=4, l=3, l=2, l=1 l=0 l=5, l=4, l=3, l=2, l=1 l=0
3+2 4+1=5 5+0=5 4+2=6 5+1=6 6+0=6
Таким
oбpaзoм,
последовательность заполнения электронами
подуровней в атомах элементов, если
сумма n+l
=
5, от 3d→4p![]() 5s,
а в случае суммы n+l
=6 - от 4d
5s,
а в случае суммы n+l
=6 - от 4d![]() 5p
5p![]() 6s.
6s.
Задача 4. Напишите электронные конфигурации следующих ионов:
AI3+, Cr3+, Fe2+, Fe3+, Cl.
Решение. Положительно заряженные ионы образуются в том случае,
когда от нейтрального атома под действием энергии извне
отрываются электроны. Отрицательно заряженные ионы
образуются при присоединении к нейтральному атому электронов. Нейтральный атом алюминия имеет следующую электронную конфигурацию: 13Al 1s22s22р63s23р1, последний застраивающийся слой 3s23р1. В том случае, когда атом алюминия (Al) превращается в ион Al3+, от нейтрального атома отрывается 3 электрона, имеющие наибольшую энергию, т.е. с 3s и 3р-подуровней, вследствие чего ион имеет следующую электронную конфигурацию: 1s22s22р63s03р0. Нейтральный атом хрома имеет электронную конфигурацию 24Cr 1s22s22p63s23р64s13d5, последний
з астраивающийся
3d
– подуровень:
астраивающийся
3d
– подуровень:
При отрыве от нейтрального атома 3-х электронов в первую очередь будут отрываться: один электрон с подуровня 4s и два электрона с подуровня 3d. При этом атом хрома превращается в ион Cr3+ и его электронная конфигурация будет такова 1s2 2s2 2p6 3s2 3р6 4s°3d3.
Нейтральный
атом железа имеет следующую электронную
конфигурацию 26Fе
1s2
2s2
2p6
3s2
3p6
4s2
3d6.
При отрыве от атома 2
электронов
атом превращается в ион Fе2+:
1s2
2s2
2р6
3s2
3р6
4s°
3d6.
При отрыве от атома 3 электронов, атом
превращается в ион Fe3+:
1s2
2s2
2p6
3s2
3p64s°3d5.
Нейтральный атом хлора имеет следующую
электронную конфигурацию 17Cl
1s2
2s2
2p6
3s2
3p5
![]() ;
приобретая один электрон, атом превращается
в отрицательно заряженный ион Сl-:
1s22s22p63s23p6
;
приобретая один электрон, атом превращается
в отрицательно заряженный ион Сl-:
1s22s22p63s23p6
![]()
Задача 5. Какие ошибки допущены в схемах распределения электронов
внешних слоев в невозбужденном состоянии атомов:
а)
Бор (В)
б)Азот
(Ш)

в)
Кислород (0) 
Решение.
а) В невозбужденного атоме бора по
принципу наименьшей энергии должен
вначале заполниться полностью s-подуровень
второго уровня, а затем электронами
заполняется р-подуровень. Правильное
распределение 2s22р1.
В
случае (б) и (в) не выполнено правило
Хунда. Электроны в пределах подуровня
должны распределяться так, чтобы
суммарное спиновое квантовое число
было максимальным. Правильное
р аспределение:
аспределение:

Задача 6. Какие вакантные орбитали, способные влиять на химические свойства элементов, имеются у атомов титана, криптона, урана?
Решение. На химические свойства элементов оказывают влияние лишь
вакантные орбитали с относительно низкой энергией.
Обычно это d-орбитали предпоследнего слоя.
Также можно отметить, что на химические свойства элементов могут оказывать влияние вакантные (n–1) f-орбитали. На химические свойства титана в основном оказывают влияние наличие у его атомов 3d-и 4р-вакантных орбиталей, у атомов криптона 4d-, а у атомов урана 5f-,6d-,7p-орбитали.
Задача 7. Одинаковы ли по энергии и ориентации орбитали двух электронов со следующими наборами квантовых чисел:
1)
n1=3;
l1=0;
m(l)=0
m(s)=![]() ;
;
2)
n2=3;
l2=1;
m(l)=1
m(s)=![]()
Решение. Энергия электрона в атоме определяется суммой энергий главного и орбитального квантовых чисел (n+l). У первого электрона (n+l) равно 3+0=3, а у второго(n+l) (3+1 )=4. Следовательно, эти два электрона имеют различную энергию. Ориентация орбиталей электронов на данном подуровне определяется магнитным квантовым числом, в нашем примере у первого электрона m(l1)=0, а у второго m(l)=1. Следовательно, ориентация орбиталей у них различная.
Задача 8. Не обращаясь к табличным данным, определите количество орбиталей, для которых n = 4, укажите значения чисел n и ml для каждой из этих орбиталей.
Решение. Для n = 4 возможные значения числа l таковы: 0,1,2,3. Это соответствует 4s-, 4р-, 4d-, 4f- подуровням. В них существуют одна 4s-орбиталь (n=4, l=0, ml=0), три 4р-орбитали (n=4, l=1, ml=1,0,+1), пять 4d- орбиталей (n=4, l=2, ml=-2,-1,0,1,2) и семь 4f- орбиталей (n=4, l=3, ml=-3,-2,-1,0,1,2,3).
Задача 9. Написать электронно-графические формулы атомов скандия, брома, молибдена в нормальном и возбужденном состоянии атома.
Решение. Электронные формулы заданных атомов в нормальном
(невозбужденном) состоянии :21Sc 1s22s22p63s23p64s23d1
35Br 1s22s22p63s23p64s23d I04 p5
42Mo 1s22s22p63s23p64s23dI04p 65s14d5
Такие электронные формулы могут быть представлены графически:
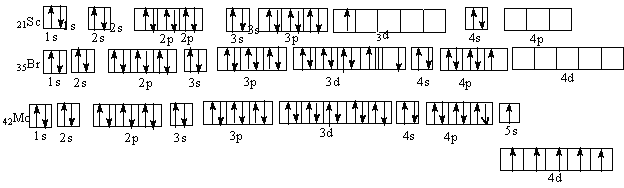
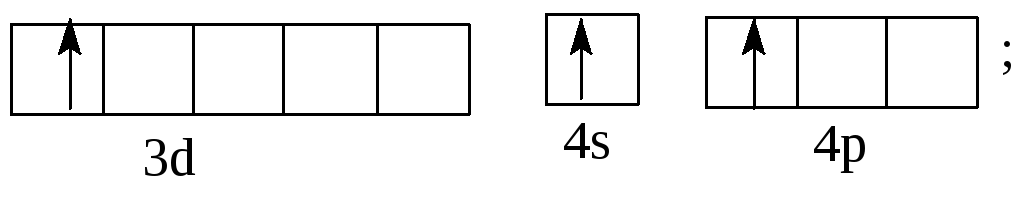
Однако наличие вакантных орбиталей у Sc в 4 уровне в подуровне 4р делает возможным возбуждение этих электронов до 4р у Sc и 4d у Вr с затратой сравнительно небольшой энергии. Электронные формулы возбужденных атомов скандия и брома таковы: Sc* 1 22 22p63s23p64sI3d14pI
максимальное возбуждение Br***ls22s22p63s23p64sI3d104p34d3