
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdfТаблица 20.9. Клинические различия между некротическим энтероколитом и спонтанной перфорацией кишечника (Caplan M., 2012)
Признак |
Некротический |
Спонтанная перфорация |
|
энтероколит |
кишечника |
Частота у детей с ЭНМТ и ОНМТ |
7-10% |
2-3% |
Возраст начала |
2-6-я недели |
0-14-й дни |
Пневматоз |
Да |
Нет |
Энтеральное питание |
Да |
Нет |
Гистологические доказательства |
Да |
Нет |
некроза ворсинок |
|
|
Летальность |
На 10-30% выше |
На 5-10% выше средней |
|
средней |
|
Среди пациентов с массой 500-750 г частота НЭК может доходить до 1320%. В 2013 г. частота НЭК в Санкт-Петербурге у детей с массой тела при рождении менее 750 г
составила 18,5%, 751-1000 г - 13%, 1001-1500 г - 12% (Федорова Л.А., 2014). Согласно M. Caplan (2012) 50% больных с НЭК требуется хирургическое вмешательство, а летальность при НЭК - 25-30%.
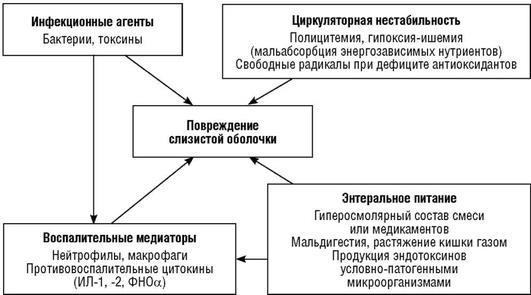
Этиология и патогенез. НЭК поражает выживающих, поправляющихся после тяжелой болезни новорожденных. Большинство из них переносят респираторный дистресссиндром (РДС, внутричерепные кровоизлияния и родовую травму) за несколько дней или недель до начала НЭК. Поскольку заболевание обычно наблюдается у недоношенных детей, многие факторы, ассоциированные с недоношенностью, рассматриваются как факторы риска НЭК.
Ишемия кишечника. Факторы риска включают асфиксию, РДС, гипоксию, гипотензию, открытый артериальный проток (ОАП), полицитемию, анемию, катетеризацию пупочной артерии (в меньшей степени пупочной вены), замен-ное переливание крови (ЗПК). Действительно, каждый из указанных факторов способен вызвать ишемию кишечника, но контролируемые исследования показали, что эти заболевания с равной частотой встречаются и у детей с НЭК, и в контрольной группе (Kleiman R.М., 1997), поэтому не рассматриваются как прямые патогенетические факторы НЭК, а лишь как частые атрибуты недоношенности. Главный фактор риска НЭК - недоношенность в сочетании с незрелостью иммунного ответа и гастроинтестинальных функций.
Некоторые факторы могут инициировать недостаточность мезентериального кровообращения уже внутриутробно - плацентарная недостаточность, употребление матерью кокаина. Дети с кокаиновой интоксикацией имеют более высокий риск развития НЭК, хотя и рождаются с относительно большей массой.
Врезультате гипоперфузии резко снижается местная резистентность слизистой оболочки, ишемические участки ее становятся более подверженными воздействию агрессивной микрофлоры, что завершает патологический процесс.
Внормальном организме поступление пищи вызывает расширение мезен-териальных сосудов, что регулируется местными гастроинтестинальными гормонами и обеспечивает секрецию пищеварительных ферментов в просвет кишки и доставку кислорода к работающему органу. Этот процесс может нарушаться в условиях незрелости ЖКТ и нарушенного местного и системного кровотока.
Нарушение механизмов ауторегуляции кишечного кровотока как в связи с изменениями центрального кровотока, так и в связи с кормлением - одно из узловых звеньев патогенеза НЭК.
Бактериальная колонизация и провоспалительный ответ. Многие эпидемиологические исследования подтверждают, что НЭК ассоциирован с одним или несколькими бактериальными агентами. У большинства детей при бактериологическом исследовании кала наблюдается рост таких микроорганизмов, как кишечная палочка, фекальный стрептококк, серрация, клебсиелла, эпи-дермальный стафилококк, клостридии и грибы рода Candida. В 25% случаев высеваются ассоциации этих агентов (Караваева С.А., 2002).
Единый идентифицированный бактериальный агент отсутствует (Норманн Э. и др., 2013), однако в некоторых экспериментальных и сравнительных исследованиях предполагается важная роль анаэробов в генезе этой патологии, в частности, Clostridium perfringens типа С и Clostridium difficile. Это доказывается типичным для НЭК пневматозом кишечника, напоминающим газовую гангрену, а также опытами на животных.
У 20-30% пациентов микробный агент выделяется из культуры крови. Чаще это грамотрицательные микробы (E. сoli, Streptococcus faecies, Serratia marcescens,
Acinetobacter, Proteus mirabilis, Klebsiella) или Staph. epidepmalis. Остается не выясненным, является ли микроорганизм, высеваемый из крови или перитоне-альной жидкости, первичным патогеном или вторично внедрившимся, который попадает в циркуляцию вследствие повреждения слизистой оболочки кишки.
Определенное значение имеет контаминация несколькими нормальными аэробными грамотрицательными симбионтами. Эндотоксины этих бактерий, обычно неопасные, при слабой элиминации или повышенной проницаемости эпителиального барьера могут вызывать воспалительные изменения слизистой оболочки кишечника с избытком синтеза провоспалительных цито-кинов и дефицитом противовоспалительных. Более того, в настоящее время установлено, что при глубокой недоношенности дети, как правило, рождаются с признаками «системного фетального воспалительного ответа» (подробнее см. главу 14).
Энтеральное питание. Несколько рандомизированных исследований конца 1980-х - начала 1990-х годов показали высокую ассоциацию частоты НЭК и раннего начала (на первых днях жизни) энтерального питания глубоко недоношенных детей, а также повышенного количества жира и белка в смесях для вскармливания. В дальнейшем, правда, выяснилось, что дело скорее в интенсивности увеличения энтеральной нагрузки (25 мл/кг в сутки и более). Установлено, что раннее начало энтерального «трофического питания» (см. главы 6, 8) уменьшает вероятность развития НЭК. Гиперосмолярные смеси и назначенные внутрь лекарства усиливают воздействие на кишечный кровоток и моторику. Превышая возможности пищеварения и всасывания, непереваренные компоненты пищи, особенно углеводы, способствуют развитию метеоризма. Высокое давление в просвете кишки при этом может редуцировать местный кровоток. При повреждении эпителия газ из полости кишки может проникать под слизистую оболочку и вызывать типичный симптом кишечного пневматоза, а в случае проникновения в сосуды - воздушную эмболию v. hepatica и v. porta. Анализ газа из пневматических кист показал, что его состав типичен для бактериальной ферментации неабсорбированных углеводов и содержит водород, углекислый газ, метан. В то же время отсрочка перевода на энтеральное питание детей, перенесших тяжелую асфиксию, катетеризацию пупочной вены и РДС, не сопровождается достоверным снижением частоты НЭК и скорее усугубляет риск осложнений, так как способствует развитию атрофии слизистой оболочки тонкой кишки, холестазу, остеопении и др.
Постпрандиальная гипоксия может вызывать нарушение пищеварения и всасывания, нарушение перистальтики и реализоваться в повреждение кишки, повышение ее проницаемости и язвообразование. Возможно, именно пост-прандиальная гипоперфузия создает у пациентов с НЭК несоответствие между повышенными потребностями в кислороде и энергии после приема пищи и недостаточными возможностями их доставки.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
НЭК обычно ассоциирован с искусственным вскармливанием, он развивается у 1,2% недоношенных, получающих материнское молоко, и у 7,2%, получающих молочные смеси. По этой причине родился афоризм: «НЭК - болезнь глубоко недоношенных детей, питающихся формулами (смесями для искусственного вскармливания)».
Установлена ассоциация повышения частоты развития НЭК с применением некоторых медикаментов (индометацина, Эуфиллина♠, натрия гидрокарбоната, препаратов кальция, высокоосмолярных растворов, антибиотиков широкого спектра, кортикостероидов и др.), наркоманией у матери.
Таким образом, в генезе НЭК нельзя выделить какого-либо одного причинно-значимого фактора. Скорее, совокупность воздействия группы энтеропато-генов на фоне незрелого иммунного и функционального ответа кишечника и реализуется в конечном итоге в болезнь (схема 20.1).
Схема 20.1. Взаимодействие факторов патогенеза НЭК
Морфология. Морфологически НЭК характеризуется воспалением и коа-гуляционным некрозом. Последний является следствием ишемии и воспаления. Осмотр поврежденных резецированных участков или аутопсийных образцов обнаруживает изъязвления слизистой оболочки кишки, геморрагии, отек и наличие подслизистых или подсерозных кист, заполненных газом, - инте-стинальный пневматоз. У 50% детей в процесс вовлекаются и тонкая, и толстая кишка (чаще илеоцекальная область), у 25% - только толстая кишка,
у 25% - только подвздошная. Реже наблюдается поражение тощей кишки, желудка, иногда процесс захватывает весь кишечник - от связки Трейтца до прямой кишки, что обычно заканчивается фатально. Поражение может быть как непрерывным, так и прерывистым.
Гистологическое исследование резецированных тканей выявляет коагу-ляционный некроз в 90% случаев, выраженное воспаление - в 90%, в 15% - эозинофилы в инфильтрате, в 75% - изъязвление, в 70% - геморрагии. Пнев-матоз при гистологическом исследовании наблюдается в половине случаев. В крупных мезентериальных сосудах тромбы находят нечасто, в мелких - в 30% наблюдений.
Репаративные процессы характеризуются регенерацией эпителия, образованием грануляционной ткани и фиброзом. Последний может в дальнейшем приводить к формированию стриктур.

В общепринятой практике в зависимости от распространенности процесса выделяют локализованную форму - поражение ограничено небольшим участком киши или
желудка; мультисегментарную форму - поражено несколько участков кишки; тотальное поражение кишечника, или паннекроз.
Клиническая картина. Ранние симптомы НЭК часто неспецифичны и включают признаки общей интоксикации и слабые гастроинтестинальные проявления. Диарея нечасто бывает первым признаком НЭК. Интоксикация может проявляться апноэ, брадикардией, вялостью, нарушением терморегуляции, цианозом и «мраморностью» кожного покрова, похолоданием конечностей. При появлении интестинальных симптомов живот становится вздутым и напряженным, кишечные шумы ослабевают. Может наблюдаться рвота, по желудочному зонду отходит обильное застойное желудочное содержимое. Иногда бывает гематеме-зис, но чаще - стул с кровью (в 80%). Однако на первом этапе болезни кровь в стуле может быть скрытой.
По мере прогрессирования болезни развиваются артериальная гипотензия, шок, ДВСсиндром. Возможны асцит, перитонит, перфорация кишки. На передней брюшной стенке могут появляться красные стрии и гиперемия вокруг пупка и по ходу пупочной вены. Может быть гиперемия в правой подвздошной области с наличием пальпируемых масс там. Это проявление перфорации с формированием локального абсцесса.
Различают три стадии развития НЭК по модифицированной классификации M.J. Bell и
соавт. (табл. 20.10).
I стадия - субклиническая, при которой не обнаруживается явных диагностических, рентгенологических или ультразвуковых признаков. На этой стадии трудно дифференцировать НЭК от других гастроинтестинальных заболеваний.
II и III стадии - это несомненный документированный НЭК. Прогрессирова-ние и переход от одной стадии к другой обычно происходит в течение 24-48 ч после начала симптомов. Однажды стабилизируясь, пациент редко переходит в следующую стадию. Большинство эпизодов перфорации наблюдается у больных IIIА-В стадии. Перфорация чаще происходит через 48-72 ч у детей с IIIА стадией.
Выделение стадий болезни позволяет более точно оценить тяжесть состояния ребенка и более четко сформулировать показания к хирургическому лечению.
Таблица 20.10. Классификация НЭК у новорожденных (Bell М.J. et al., 1978; Wаlsh М.C. et al., 1986)
Стадия |
Общие |
Интестинальные |
Рентгенологическая |
|
симптомы |
симптомы |
картина |
IА (подозрение на НЭК) |
Нестабильность |
Незначительное |
Норма или |
|
температуры, |
вздутие живота, |
некоторое вздутие |
|
апноэ, брадикар- |
рвота. Скрытая |
петель кишечника |
|
дия, вялость |
кровь в стуле |
|
IБ (предполагаемый НЭК) |
То же |
То же + примесь |
То же |
|
|
ярко-красной |
|
|
|
крови в стуле |
|
IIА (определенный НЭК, легкая |
То же + |
То же + парез |
Расширение |
форма, обратимая стадия) |
незначительный |
кишечника, т. е. |
кишечных петель с |
|
метаболический |
снижение или |
множественными |
|
ацидоз и |
отсутствие |
горизонтальными |
|
незначительная |
кишечных |
уровнями, пневма- |
|
тромбоцитопенияшумов с |
тоз кишечной |
|
|
|
реакцией на |
стенки |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

|
|
пальпацию или |
|
|
|
|
без таковой |
|
|
|
|
|
|
|
IIБ (определенный НЭК, среднетя- |
То же + |
То же + |
То же с (или без) |
|
желая форма, необратимая |
метаболический |
выраженное |
газом в v. porta, с |
|
стадия) |
ацидоз и |
вздутие и |
(или без) асцитом |
|
|
тромбоцитопениянапряжение |
|
||
|
|
живота с (или |
|
|
|
|
без) |
|
|
|
|
абдоминальным |
|
|
|
|
целлюли-том |
|
|
|
|
или |
|
|
|
|
пальпируемыми |
|
|
|
|
массами в |
|
|
|
|
правом нижнем |
|
|
|
|
квадранте |
|
|
IIIА (прогрессирующий НЭК, |
То же + |
То же + |
То же + всегда газ |
|
тяжелая форма) |
смешанный |
симптомы |
в v. porta и |
|
ацидоз, |
перитонита, |
выраженный асцит |
||
|
||||
|
артериальная |
гиперемия |
|
|
|
гипотензия, |
передней |
|
|
|
брадикардия, |
брюшной |
|
|
|
повторные апноэ, стенки, |
|
||
|
нейтропения, |
кровавый стул, |
|
|
|
анурия, |
парез |
|
|
|
коагуляци-онные кишечника с |
|
||
|
нарушения |
реакцией на |
|
|
|
|
пальпацию |
|
|
|
|
живота |
|
|
IIIБ (прогрессирующий НЭК, |
То же + |
Разлитой |
То же + пневмопе- |
|
перфорация) |
декомпен- |
перитонит, |
ритонеум |
|
|
резкое вздутие |
|
||
|
сированный |
|
||
|
живота, |
|
||
|
|
|
||
|
ДВС-синдром |
кровавый стул, |
|
|
|
|
парез |
|
|
|
|
кишечника с |
|
|
|
|
реакцией на |
|
|
|
|
пальпацию |
|
|
|
|
живота |
|
|
Течение. С.А. Караваева (2002) выделила три варианта течения НЭК: молниеносное, острое и подострое.
Молниеносное течение характерно для доношенных крупных детей, перенесших в родах асфиксию, травму головного и/или спинного мозга, а также для новорожденных с гемолитической болезнью (особенно после повторных ЗПК) и для больных с пороками ЖКТ (острая форма болезни Гиршпрунга, гастро-шизис). От первых нечетких симптомов дискомфорта в состоянии ребенка, которые появляются на 3-5-й дни жизни, до возникновения перфорации проходит не более 1,5-2 сут. Своевременная диагностика этой формы заболевания может быть затруднена из-за преморбидного фона и очень тяжелого общего состояния
ребенка, что иногда затушевывает признаки надвигающейся катастрофы. Однако
появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Острое течение НЭК характерно для недоношенных детей с массой тела при рождении менее 1500 г. Заболевание развивается на 2-4-й неделях жизни с ярко выраженных симптомов со стороны брюшной полости: срыгивания и рвота, отказ от еды, вздутие живота, нарушение пассажа по кишечнику, что соответствует стадии заболевания IА. Вскоре присоединяются общесоматические симптомы, свидетельствующие об интоксикации и дисфункции жизненно важных органов и систем. При отсутствии адекватной терапии НЭК переходит в необратимую стадию развития процесса, что требует незамедлительного хирургического вмешательства.
Подострое течение особенно характерно для пациентов с экстремально низкой массой тела. Болезнь развивается постепенно с 3-й недели жизни: ребенок перестает усваивать питание, начинает срыгивать, возникает вздутие живота, меняется характер стула - он учащается, в нем появляется примесь зелени и слизи, крови, а иногда, наоборот, он становится более редким и вообще прекращается. Симптомы со стороны ЖКТ имеют перемежающийся характер: периоды внешнего благополучия сменяются ухудшением и возвратом кишечного синдрома.
Диагностика. С самого начала заболевания необходимо частое повторное исследование ребенка (каждые 6-8 ч), которое включает пальпацию живота и лучевые исследования брюшной полости (УЗИ и по показаниям рентгенография), чтобы не пропустить ухудшение состояния и развитие осложнений. Наблюдение за ребенком осуществляют совместно неонатолог и хирург.
Абсолютными рентгенологическими признаками обратимой стадии НЭК являются:
•неравномерное вздутие кишечных петель;
•ограниченный пневматоз кишечной стенки;
•отдельные паретические уровни в кишечнике.
К абсолютным рентгенологическим признакам некроза кишки относятся:
•статичная, «стабильная» петля кишки на рентгенограммах, сделанных с интервалом 6-12 ч;
•обширный пневматоз кишечника;
•газ в воротной вене;
•асцит;
•пневмоперитонеум.
С.А. Караваева (2002) пришла к заключению, что при неясной клинической картине НЭК и анатомических особенностях, обусловленных врожденными пороками развития (атрезия пищевода и др.), как средство диагностики необходимо применять лапароцентез с целью ранней диагностики некроза кишки.
Лабораторные данные помогают в оценке состояния ребенка: тромбоци-топения в сочетании или без ДВС-синдрома, ацидоз, анемия, нейтропения с резким сдвигом влево являются тревожными признаками прогрессирующего НЭК.
Дифференциальную диагностику следует проводить с целым рядом системных и гастроинтестинальных заболеваний (табл. 20.11).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Таблица 20.11. Дифференциальная диагностика НЭК
Системные болезни |
Гастроинтестинальные болезни |
Родовая черепно-спинальная |
Заворот кишки. |
травма, цере-бровисцеральный |
Мальротация. |
синдром. Перинатальные инфекции. |
|
Сепсис. |
Некротический колит. |
Геморрагическая болезнь новорожденных. Синдром заглоченной крови.
Постасфиксический некроз кишки Тромбоэмболия пупочных артерий. Спонтанная перфорация кишки. Стресс-язва в первые 5 дней жизни. Мекониальный илеус. Аллергия к белку коровьего молока
Лечение. Интенсивная терапия дает положительные результаты у 6070% больных НЭК, в остальных случаях требуется хирургическое вмешательство.
Консервативное лечение предусматривает:
•отмену энтерального питания;
•декомпрессию желудка и кишечника;
•полное и полноценное парентеральное питание;
•антибактериальную терапию;
•медикаментозное воздействие на парез кишечника;
•ферментотерапию и пробиотики;
•иммунотерапию.
При установленном диагнозе НЭК кормление ребенка полностью прекращают, переводя его на полное парентеральное питание на 5-7 дней, затем постепенно начинают вводить сцеженное грудное молоко, при его отсутствии - безлактозные формулы (смеси).
С целью кишечной декомпрессии применяют отсасывание через постоянный назогастральный зонд при отрицательном давлении не более минус 6080 мм рт.ст.
Адекватное парентеральное питание - один из ключевых методов лечения ребенка с НЭК. Ребенок, не получающий адекватной питательной поддержки, голодающий ребенок, гомеостатические механизмы которого повреждены. Принципы парентерального питания изложены в главах 6 и 8.
Антибактериальные препараты и их режимы при НЭК строго не детерминированы, но тактика врача должна быть гибкой, и начало НЭК на фоне анти-биотикотерапии требует смены антибиотиков. Наиболее эффективно назначение ванкомицина по 10 мг/кг внутривенно 3-4 раза в день и метронидазола 15 мг/кг в сутки внутривенно в 2 введения. Применяют также цефалоспорины
III-IV поколений в сочетании с аминогликозидами, карбапенемы. Смену антибиотиков проводят в соответствии с результатами бактериологического исследования крови, перитонеальной жидкости и стула. Длительность курса антибиотиков при I стадии НЭК небольшая - 3-5 дней, при IIА стадии - 7-10 дней, при IIБ-III стадии - 14 дней.
Иммунотерапию проводят иммуноглобулинами для внутривенного введения, оптимально содержащими иммуноглобулины М (Пентаглобин♠). Последний вводят в течение трех дней подряд.
При тяжелом НЭК проводится осторожная коррекция гиповолемии и нарушений свертывания крови переливанием свежезамороженной плазмы 1015 мл/кг, тромбоцитной массы, инфузия глюкозо-солевых растворов, калия. В целях улучшения оксигенации и коррекции ацидоза показана ИВЛ, при септическом шоке и циркуляторной недостаточности назначают инотропные средства (допамин, добутамин). Назначение инотропов, вазоконстрикторов и вазодилататоров должно тщательно контролироваться и подбираться по показателям центрального и периферического кровотока (оптимально по результатам допплеровского исследования), диуреза, КОС и ЦВД и корректироваться инфузионной терапией. Полное парентеральное питание предусматривает и ежедневное введение витаминно-минеральных комплексов (см. главу 6). Важно помнить, что слишком быстрое увеличение нагрузки липидами при парентеральном питании повышает риск НЭК.
Абсолютным показанием к хирургическому лечению является пневмопери-тонеум. Однако своевременная декомпрессия брюшной полости позволяет снизить интраабдоминальное давление и восстановить артериальный кровоток, оксигенацию и сердечный возврат. Поэтому при симптоматике IIIА стадии показан лапароцентез и дренирование брюшной полости. Если в течение 24-48 ч не наступает улучшения состояния, проводится лапаротомия и удаление некротизированных тканей и воспалительного экссудата. Эта тактика более раннего оперативного лечения позволяет предотвратить переход в IIIБ стадию и снизить летальность.
Одним из самых тяжелых осложнений хирургического лечения НЭК является синдром короткой кишки, который более подробно описан в следующем разделе.
Прогноз. Летальность при НЭК остается высокой и в разных отделениях реанимации и интенсивной терапии колеблется от 9 до 28%, особенно среди детей с массой менее 1500 г. Примерно треть детей требуют хирургического вмешательства, летальность в этой группе составляет 40-50%. Среди выживших детей возможны отдаленные осложнения НЭК: стриктуры толстой кишки, синдром короткой кишки, а также неврологические изменения, связанные с последствиями сепсиса и шока. Дети с НЭК нуждаются в длительном (в течение 1-3 лет) реабилитационном лечении под наблюдением хирурга, гастроэнтеролога, невропатолога, окулиста, поскольку рациональная восстановительная терапия может существенно улучшить качество жизни детей, даже при наличии отдаленных последствий.
Профилактика. На современном этапе развития неонатологии НЭК не может быть полностью устранен, но некоторые профилактические меры с учетом механизмов его развития должны предприниматься для его предупреждения. В нескольких рандомизированных исследованиях показана эффективность пробиотиков (Bifidobacteriae bifidum, Lactobacillus GG) и назначаемого внутрь IgA, а также протективная роль грудного молока. Раннее начало вскармливания грудным молоком достоверно снижает частоту НЭК. Однако расширение объема питания должно быть постепенным, не превышать 20 мл/кг/сут и проводиться с обязательной оценкой индивидуальной толерантности к пище. Считается, что среди положительных эффектов антенатального применения стероидов при угрозе преждевременных родов есть и уменьшение вероятности развития НЭК у недоношенного ребенка (вероятно, вследствие снижения активности синдрома «фетального системного воспалительного ответа»).
20.2.15. Синдром короткой кишки
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Синдром короткой кишки (СКК) - это кишечная недостаточность, которая является результатом обширной резекции тонкой кишки. В определении СКК подразумеваются тяжелая мальабсорбция нутриентов и водно-электролитные нарушения, которые ставят пациента в зависимость от парентерального питания (ПП). Большинство случаев СКК возникает в периоде новорожденности и является результатом хирургических операций при врожденных аномалиях или тяжелом некротическом энтероколите.
К счастью, тонкая кишка имеет большие функциональные резервы и 40-50% ее может быть резецировано без существенных метаболических и трофических последствий. При удалении более 75% нутриционный статус и дальнейшее развитие ребенка могут поддерживаться благодаря ПП, при остаточной длине ТК более 80 см ПП обычно не требуется, даже при остаточной длине около 40 см 94% детей выживают без необходимости постоянного ПП.
Этиология. У новорожденных причины СКК включают некротический энтероколит (НЭК), атрезию, протяженный интестинальный аганглиоз и маль-ротацию с кишечной непроходимостью. Гастрошизис обычно сопровождается СКК вследствие тех же механизмов: заворота, атрезии или НЭК. СКК, развившийся при НЭК, протекает обычно более тяжело, чем СКК другой этиологии, и требует более длительной госпитализации. Вероятно, это связано с большей степенью кишечной недостаточности вследствие поражения слизистой оболочки остаточной кишки.
Патогенез. В результате обширной резекции тонкой кишки происходят следующие нарушения.
Водно-электролитные потери
На ранних стадиях после резекции могут быть значительные водно-электролитные потери, при этом наблюдается снижение электрической резистентности и повышение проницаемости оставшегося отрезка кишки. Резекция подвздошной кишки приводит к попаданию большого количества желчных кислот и липидов в толстую кишку. Здесь они метаболизируются микрофлорой
до деконъюгированных желчных кислот и жирных кислот, которые усиливают секрецию в ТК.
Тонкая кишка имеет особенности функционирования на всем своем протяжении. Существуют важные различия между тощей и подвздошной кишками, в дистальных отделах подвздошной кишки существуют специфические сайты всасывания для некоторых витаминов, желчных кислот, поэтому иле-альная резекция приводит к их мальабсорбции. Различия между тощей и подвздошной кишками касаются также проницаемости межэпителиальных промежутков между энтероцитами, определяющих способность к абсорбции воды и электролитов против осмотического градиента. Тощая кишка имеет большую проницаемость, чем подвздошная, а та, в свою очередь, более проницаема, чем толстая. Межэпителиальные соединения между энтероцитами в подвздошной кишке относительно непроницаемы для воды и электролитов, что ограничивает обратную диффузию натрия в межклеточное пространство и полость кишки. Поэтому резекция подвздошной кишки приводит к большей потере воды и электролитов.
Толстая кишка - важнейшее место всасывания натрия и воды, она имеет большие резервные возможности, поэтому больные с сохранной толстой кишкой меньше страдают от недостатка воды и электролитов.
Нарушения транспорта и кишечный дисбиоз
Массивная резекция кишечника сопровождается снижением гастродуоде-нальной моторики, замедлением эвакуации и продвижения по кишке. Хотя это обеспечивает более
длительный контакт всасываемых пищевых веществ с эпителием кишки, медленный транзит может быть одним из факторов усиленного микробного роста, который развивается у 2/3 детей с СКК. Это препятствует своевременной отмене ПП и переходу на энтеральное питание (ЭП) и способствует развитию воспалительных изменений в слизистой оболочке тонкой кишки (СОТК).
Нарушения пищеварения и всасывания
После полной резекции тощей кишки может наблюдаться лишь небольшая стеаторея, в то же время потеря всего 10 см подвздошной кишки вызывает выраженную стеаторею из-за мальабсорбции желчных кислот. Несмотря на компенсаторное повышение синтеза желчных кислот в печени, их пул значительно снижается, что нарушает мицеллообразование и приводит к нарушению всасывания жиров и жирорастворимых витаминов.
Другие факторы, усиливающие стеаторею, включают: инактивацию панкреатических ферментов вследствие повышения желудочной секреции, кишечный дисбиоз и панкреатическую недостаточность, вторично развивающуюся при недостаточности питания.
В зависимости от протяженности резекции развивается дисахаридазная, в частности лактазная, недостаточность, которая пропорциональна длине резецированной кишки. Нарушения пищеварения значительно нарастают при наличии воспаления в кишечнике, в частности при НЭК.
Желудочная гиперсекреция
Гиперсекреция соляной кислоты в желудке обычно транзиторна и пропорциональна резецированной длине кишки. При этом возможны формирование гастродуоденальных язв и эрозий, кровотечения из них, а также мальабсорбции вследствие инактивации панкреатических ферментов и нарушения формирования мицелл. Закисление двенадцатиперстной кишки может нарушать всасывание глюкозы. Гиперсекреция является результатом гипергастринемии, которая развивается вследствие недостаточности гастринингибирующего пептида, синтезируемого тонкой кишкой.
D-лактоацидоз
Рецидивирующий D-лактоацидоз является нечастым осложнением СКК. Невсосавшиеся вследствие резекции тонкой кишки углеводы ферментируются лактобациллами толстой кишки до D- и L-изомеров молочной кислоты. L-лак-таты далее метаболизируются с помощью L-лактатдегидрогеназы, но подобного пути не существует для D-изомеров. В этом случае у пациентов развиваются тяжелый ацидоз и значительные нарушения сознания.
Преходящая псевдообструкция
Обширная резекция тонкой кишки у новорожденных может привести к расширению и нарушению моторики кишки с развитием тяжелой псевдообструкции. Остаточная кишка часто контаминирована микрофлорой. К счастью, псевдообструкция обычно устраняется параллельно с адаптацией слизистой оболочки.
«Адаптация» - термин, который применяется для обозначения процесса прогрессивного улучшения при кишечной недостаточности вследствие потери длины кишки. Он состоит в повышении толерантности к энтеральному питанию, что позволяет постепенно уменьшать объем ПИП. В процессе адаптации кишка увеличивается в диаметре, удлиняется и истончается. Ворсинки становятся длиннее, крипты глубже, с большим количеством клеток в пролифера-тивной зоне. Эти изменения можно наблюдать уже через сутки после
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
