

•ТЦ нах-ся на внутренней пов-ти БСР. Здесь работает фермент пептилтрансфераза, который катализирует реакцию образования пептидной связи м/у карбокси - групплой пептидил тРНК, нах-ся в ПЦ, с амино-группой аминоацил т- РНК,расположенной в АЦ.
•ЭЦ нах-ся рядом с ПЦ и ТЦ. В него попадает тРНК, освободившаяся от пептида из РЦ
По хим.составу РСрибонуклеопротеин.
В70S входят 3 вида рРНК23S и 5S в БСР, 16S в МСР.
В80S входят 4 вида рРНК28S, 5,8S, 5S в БСР, 18S в МСР.
Синтез рРНК и сборка рибосом происходит в ядрышке.
Включения – непостоянные компоненты клеток. Бывают:
-трофическими (питательные вещ-ва – жиры, крахмал, гликоген и др.)
-секреторные (хим.вещ-ва, синтезирующиеся в клетке, идущие на экспорт – гормоны)
-специальные ( в высокодифферинцированных клетках (гемоглобин в эритроцитах))
Клеточный центр – универсальный немембранный органоид эукариотических клеток животных, построен из белков-тубулинов.
Находится в геометрическом центре клетки около ядра. Представляет собой цент организации микротрубочек. Состоит из центросферы и центросомы (образованы МТ α и β тубулина).
Центросфера – совокупность |
|
Центросома – центриоли, чьи стенки |
радиально расходящихся МТ, а |
|
образованы 9 триплетами МТ, с «динеиновыми |
также миофибриллы и |
|
ручками» (моторный белок-динеин с АТФ-азной |
промежуточные филаменты, |
|
активностью). Внутри нее белковая стержневая |
которые фиксируют КЦ в ЦП |
|
структура – ось, от которой отходят 9 белковых |
|
|
фибрилл-спиц, они соединяются с МТ, |
|
|
формируя скелет центриолей. |
Структура ЦО и общая организация КЦ меняются в течение всего клеточного цикла. |
||
|
|
|
Видоизмененный КЦ участвует в образовании жгутиков у жгутиконосцев и ресничек у |
||
инфузорий, а также в специализированных клетках многоклеточных животных и человека (эпителиальные клетки дыхательных путей имеют реснички, жгутик сперматозоиды). Патология в связи нарушения сборки МТ – синдром неподвижных ресничек.
Функции КЦ: 1) организует сборку интерфазных МТ. 2) обеспечивает сборку нитей веретена деления в период клеточного деления.
Изменения за клеточный цикл:
ВG1 период : число ЦО= 2. 1 диплосома
ВS период: ЦО= 4. КЦ=4ЦО (2 диплосомы)
Впрофазе диплосомы расходятся
Перед делением клетки: в материнской ЦО инициируется сборка МТ (веретено деления)

Микрофиламенты –— компонент цитоскелета эукариотических клеток. Они тоньше микротрубочек и по строению представляют собой тонкие белковые нити диаметром около 6 нм. Основным белком, входящим в их состав, является актин. Также в клетках может встречаться миозин. В связке актин и миозин обеспечивают движение, хотя в клетке это может делать и один актин (например, в микроворсинках).
Каждый микрофиламент представляет собой две перекрученные цепочки, каждая из которых состоит из молекул актина и других белков в меньших количествах.
В некоторых клетках микрофиламенты образуют пучки под цитоплазматической мембраной, разделяют подвижную и неподвижную часть цитоплазмы, участвуют в эндо- и экзоцитозе. Также функциями являются обеспечение движения всей клетки, ее компонентов и др.
12. Ядро, строение и функции
Ядро-сложная субсистема, обеспечивающая хранение, воспроизведение, реализацию, восстановление (репарацию) генетической информации.
Включает в себя следующие основные компоненты:
Поверхностный аппарат ядра или кариотека, состоит из ядерной оболочки, поровых комплексов и периферической
плотной пластины (ламины).
Ядерная оболочка образована наружной и внутренней мембранами, между которыми находится перинуклеарное пространство. Наружная мембрана является продолжением мембраны шероховатой эндоплазматической сети, поэтому на ее поверхности

обнаруживаются рибосомы, а перинуклеарное пространство, в свою очередь, сообщается с полостью шероховатой ЭПС. Обе мембраны ядерной оболочки имеют жидкостно-мозаичное строение, характеризуются низким содержанием холестерола и кардиолипина, а также включают мембранные белки, функционирующие в качестве переносчиков, рецепторов и ферментов. Белки, расположенные в наружной мембране, связаны с цитоскелетом и белками внутренней мембраны, которые поддерживают форму ядра, участвуют в организации хроматина,в репарации и контроле транскрипции.
Ядерная оболочка выполняет функцию разделения внутриядерного содержимого от цитоплазмы, формируя отдельный
компартмент клетки для хранения и
Через поровые комплексы осуществляется транспорт веществ из ядра в цитоплазму и обратно. Кроме транспортной функции,
ядерные поровые комплексы
В некоторых участках наружная и внутренняя мембраны сливаются и образуют поры диаметром до 100 нм. Поры заполнены ядерными поровыми комплексами из белковнуклеопоринов, которые формируют три белковых кольца: цитоплазматическое, мембранное (внутреннее) и ядерное. Каждое кольцо состоит из восьми белковых субъединиц, имеющих гидрофобные участки для заякоривания в билипидном слое. Между кольцами расположены восемь белковых спиц (колонн), закрепляющих их в мембране. От белковых колец внутрь порового комплекса отходят белковые фибриллы, образующие «ловчие сети», которые обеспечивают избирательную проницаемость ядерной поры. Кроме того, фибриллярные белки, обращенные в гиалоплазму, связываются с компонентами СОСА, а другие, обращенные в ядро, образуют «ядерную корзину».
Ионы, АТФ, нуклеотиды, мелкие и средние органические молекулы могут относительно свободно диффундировать через поровые комплексы. Из ядра в цитоплазму транспортируются: субъединицы рибосом и различные виды РНК (т-РНК, м-РНК и mi-РНК) с помощью специальных белков-экспортинов, которые содержат определенную аминокислотную последовательность
— сигнал ядерного экспорта, взаимодействующий с разными РНК и способствующий их прохождению через «ловчую сеть».
В ядро из гиалоплазмы транспортируются нуклеофильные белки, например, гистоны. Более крупные белки-ферменты: полимеразы, факторы транскрипции и рибосомные белки могут проходить через пору только, если они имеют «сигнал ядерной локализации». С помощью такого сигнала ферменты взаимодействуют с белком-импортином, который обеспечивает их

проникновение сквозь фибриллы порового комплекса. Белки, содержащие две последовательности сигналов импорта и экспорта, например, регуляторы биологических часов, могут перемещаться через поровые комплексы в разных направлениях с помощью специальных ферментов — Ran-ГТФаз.
Под внутренней мембраной ядерной оболочки в клетках животных располагается ламина,
или периферическая плотная пластина (ППП), образованная фибриллярными белками — ламинами А, В, и С. Ламина:
обеспечивает структурную связь между ядром и цитоскелетом через белковый
комплекс LINC, включающий белки внутренней и наружной ядерной мембраны, которые пронизывают перинуклеарное пространство.
Структурная функция ламины заключается в поддержании формы ядра, а также в укладке или пространственной организации хромосом, которые прикрепляются к белкам ламины, образуя ламин-ассоциированные районы. Точки прикрепления хромосом характеризуются низкой плотностью генов и низким уровнем их экспрессии.
Таким образом, ламина регулирует организацию генома и структуру хроматина как за счет прямого взаимодействия с ними, так и опосредованно через взаимодействие с регуляторными белками.
Ламина может регулировать работу генов за счет накопления транскрипционных факторов вблизи внутренней мембраны.
Участвует в регуляции апоптоза, регуляции клеточного цикла и в цитодифференцировке. Известны мутации в гене ламина А (LMNA), которые приводят к возникновению наследственного заболевания — прогерии Хатчинсона–Гилфорда, или синдрома ускоренного старения. Дефект гена LAMIN A/C, кодирующего белок-преламин А («прогерин»), который является предшественником зрелых форм ламинов А и С, приводит к нарушению процессинга преламина А и его накоплению в клетке. У больных ядерные оболочки клеток сморщиваются, ядра приобретают неправильную форму, клетки не могут нормально делиться, организм перестает расти, теряет способность заменять отмирающие клетки новыми, что и приводит к ускоренному старению и снижению продолжительности жизни. Описаны мутации в гене ламина А, приводящие к кардиомиопатии.
Кариоплазма
Это внутренняя среда ядра, представляющая водный раствор органических веществ и ионов. В ней содержатся ядерный матрикс, хроматин, ферменты гликолиза и другие белки,
например, белок-убиквитин, который участвует в нелизосомальном расщеплении белков.
Кариоплазма создает специфическую среду, необходимую для протекания матричных процессов.
Ядерный матрикс включает разнообразные белки:
структурные —актин и коллаген, которые совместно с белками ламины поддерживают форму ядра и составляют кариоскелет;
белки-ферменты
регуляторные белки матричных процессов и белки, участвующие в организации хроматина.
Вядерном матриксе выделяют ядрышковую и интерхроматиновую сеть.
Ядрышковая сеть (ядрышко) образована из фибриллярных и гранулярных компонентов. Фибриллярный компонент представлен участками хромосом, имеющих вторичную перетяжку или ядрышковый организатор, в котором локализованы множественные копии генов р-РНК; с этих генов постоянно происходит транскрипция и образуются копии р-РНК, взаимодействующие с рибосомальными белками (р-белки), транспортированными из цитоплазмы. Объединение р-РНК и р-белков приводит к формированию больших и малых рибосомальных субъединиц, которые и составляют гранулярный компонент ядрышковой сети.
Интерхроматиновая сеть участвует в пространственной организации хроматина, в частности в его компактизации и регуляции активности генов. Белковые компоненты этой сети обеспечивают формирование хромомерного уровня организации хроматина, отвечая за

присоединение к последнему соответствующих ферментов в точках инициации матричных процессов.
Таким образом, ядерный матрикс обеспечивает пространственную организацию хроматина, участвует в образовании ядрышка и инициирует матричные процессы.
Хроматин
представляет собой комплекс ДНК и белков-гистонов(гистоны впервые у морских ежей), или дезоксирибонуклеопротеид. Из хроматина построены хромосомы.
Белки-гистоны являются важной составной частью хроматина, поскольку обладают щелочными (основными) свойствами и хорошо взаимодействуют с ДНК. В настоящее время известны 5 главных видов гистонов: Н1, Н2А, Н2В, Н3, Н4, которые в хроматине содержатся в соотношении 1 : 2 : 2 : 2 : 2 соответственно. Поскольку длина всех молекул ДНК, выделенных из одно й
клетки, достигает примерно 1,7 метра, а величина отдельных хромосом составляет до 8,5 см, то в ядре ДНК укорачивается путем ее спирализации и компактизации за счет взаимодействия с гистонами и белками ядерного матрикса. На этой основе формируется три универсальных уровня пространственной организации хроматина: нуклеосомный,
нуклеомерный, хромомерный.
Нуклеосомный уровень характеризуется образованием белковых коровых частиц, которые образованы 8 молекулами разных гистонов (Н2А, Н2В,Н3, Н4х2). Коровая частица взаимодействует с участком ДНК величиной примерно 145–146 п.н. При этом ДНК оборачивается вокруг нуклеосомы примерно 1,5 раза и закрепляется с помощью гистона Н1. Одновременно с ДНК взаимодействует много коровых частиц и поэтому образуется нуклеосомная нить, которая выглядит как ряд бусинок (нуклеосом),
соединенных линкерной ДНК. За счет
Концевые домены положительно заряженных гистонов Н1 взаимодействуют между собой, сближая соседние нуклеосомы, что приводит к формированию нуклеомерного уровня организации хроматина. Взаимодействие гистонов Н1 между собой становится возможным только после их фосфорилирования. Группы из 4–12 нуклеосом образуют нуклеомеры, и ДНК вследствие этого укорачивается примерно в 40 раз, т.е. происходит еще большая компактизация хромосом, особенно во время деления и образования хроматид. Нуклеомерный уровень организации хроматина препятствует участию ДНК в репликации и транскрипции.
Хромомерный уровень организации формируется за счет укладки петлями нуклеомерного хроматина вокруг белков интерхроматиновой сети, ядерного матрикса и ламины, что приводит к образованию хромомер в виде розеток. На этом уровне организации хроматиновые нити имеют толщину около 300 нм и компактизированы уже в 1000 раз.
Все три уровня организации хроматина взаимосвязаны и при определенных условиях могут переходить друг в друга. То есть, нуклеомерный хроматин одной петли хромомеры может переходить на нуклеосомный уровень, и тогда гены, локализованные в этой петле ДНК, становятся активными, без нарушения хромомерной организации остального хроматина.
Хромосомы в течение интерфазы распределены не случайным образом, а образуют хромосомные территории, то есть каждая занимает ограниченный ядерный субдомен. Под

световым микроскопом в ядрах большинства клеток видны хромосомы в виде структуры
тороида, петли которого уложены вдоль специальных скаффолд-белков. Основная масса хроматина имеет
бледную окраску за счет слабого поглощения красителя и называется эухроматином. Другая его часть окрашивается более интенсивно, имеет более темную окраску и называется гетерохроматином. Интенсивность окрашивания эу- и гетерохроматина зависит от степени спирализации, а последняя, в свою очередь, отражает функциональную активность хроматина. Поскольку эухроматин имеет невысокую степень спирализации, то может служить матрицей для синтеза РНК, т.к. содержит активные гены. Гетерохроматин сильно спирализован и может переходить в эухроматин путем деспирализации и участвовать в транскрипции. Такой гетерохроматин называют функциональным (факультативным). Гетерохроматин, не способный к транскрипционной активности, выполняет только структурную функцию, образуя центромерные и теломерные районы хромосом. Деспирализация хроматина является одним из способов регуляции экспрессии генов.
Последовательности ДНК. При цитодифференцировке ДНК можно выделить 3 типа последовательностей:
1)Уникальные последовательности (в ДНК встречаются 1-10 раз-1,5 % от всей ДНК). Сюда относятся гены основных белков. В основном это гены роскоши, которые отвечают за цитодифференцировку и адаптационный ответ.
2)Умеренноповторяющиеся последовательности (от 10 до 1000 раз. Составляют примерно 45% всей ДНК. Например, гены, кодирующие рРНк, мРНК, гены гистонов, актинов, тубулинов и т.д.) сюда относятся гены домашнего хозяйства, транслоказы, которые могут перемещаться из одного участка генома в другой, могут стать причиной мутаций)
3)Высокоповторяющиеся последовательности ( генов не содержат) этот вид последовательности выполняет структурные функции, из них образуются центромерные, теломерные участки хромосом, необходимые во время конъюгации ДНК во время мейоза, локализовано большое количество последовательностей, выполняющих регуляторную функцию.
13. Структура ДНК. Репликация ДНК.
•ДНК открыта в XX веке Уотсоном и Криком.
•Мономер ДНК – Дезоксирибонуклеотиды. ( АЗОТИСТОЕ ОСНОВАНИЕ + 5- УГЛЕРОДНЫЙ САХАР ДЕЗОКСИРИБОЗА+ ОСТАТОК ФОСФОРНОЙ КИСЛОТЫ)
•Пуриновые основания: Аденин, Гуанин
•Пиримидиновые основания: Цитозин, Тимин (В РНК вместо Тимина – Урацил – урод)
•Аденин комплементарен Тимину – двойная водородная связь; Цитозин – Гуанину и тут 3х связь – принцип ключ-замок
•Связь м/д нуклеотидами – фосфодиэфирная между САХАРОМ и остатком ФОСФОНОЙ КИСЛОТЫ

СМОТРИ НАВЕРХ!!!! АЗОТИСТЫЕ ОСНОВАНИЯ ВНУТРИ ЦЕПИ!!! МЕЖДУ НИМИ ВОДОРОДНАЯ СВЯЗЬ - МЕЖДУ КИСЛОРОДОМ И ВОДОРОДОМ!!! ВАЛЕНТИНА ПЕТРОВНА СКАЗАЛА ЭТО ВАЖНЕЕ, ЧЕМ ВСЯ ТВОЯ ЖИЗНЬ
•Один оборот спирали = 10 пар нуклеотидов.
•По правилу Чаргаффа число пуринов равно число пиримидинов, что следует из правила комплементарности – если вдруг будет что-то вроде задачи говорите – не ошибётесь.
•У сахара есть третий углерод начиная с полуацетального гидроксила => если одна из цепей начинается с этого конца, то она идет в направлении 3 – 5 конец. НО ВТОРАЯ цепь антипараллельна ей, поэтому пойдёт от 5 -3 концу.
•Ренатурация = гибридизация ДНК – восстановление двойной спирали по правилу комплементарности при попадании в нормальные условия.
•ДНК есть в ядре, в митохондриях (кольцевая), у бактерий чаще всего только кольцевая одна.
РНК
Отличия:
-Вместо дезоксирибозы – рибоза
-Вместо тимина – урацил
-В клетке находится почти везде
-Одноцепочная структура
-Образуется в результате транскрипции, а не репликации ( но мб обратные транскриптазы, которые синтезируют РНК с днк – у вирусов)
Виды РНК:
1)информационная = матричная
2)рибосомальная
3)транспортная
4)малая – ядерная
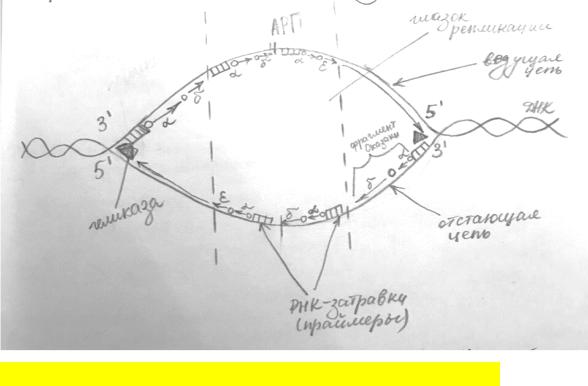
РЕПЛИКАЦИЯ ДНК

•процесс удвоения ДНК, в результате чего образуются две дочерние молекулы ДНК - копии материнских. Происходит в ядре в S – периоде.
•Биологическое значение репликации - происходит перед клеточным делением, для того чтобы хромосомы могли равномерно распределиться между дочерними клетками
•Синтез происходит на РЕПЛИКОНАХ – участок, ограниченный точками инициации и терминации ( на одной молекуле одновременно существует несколько репликонов – активируются независимо друг от друга)
•Участок,с которого начинается репликация - АРП (автономно реплицирующиеся последовательности)=> Образуется небольшая затравка ( 30 -500 нуклеотидов, причем много А-Т, т.к. м/ д ними 2Х свяхи и энергии тратится меньше). Осуществляется за счет комплекса, содержащего белки и ферменты – РЕПЛИСОМА ( в него входят : ДНК – геликаза; стабилизирующие белки; ДНК – полимераза а; праймаза; эндонуклеаза; ДНК – лигаза)
Этапы:
1. Фермент, взаимодействубщий с точками АРП - ГЕЛИКАЗА(2 геликазы прикрепляются) - разрывает двойные связи между азотист. основаниями в две стороны (в противополож. напрявл), двойная спираль ДНК расплетается,образуя репликационную вилку, каждая из которой будет являться матрицей
2.SSB-белки(стабилизирубщие белки)- присоединяются вдоль одноцепочечных нитей ДНК,для того,чтобы днк между собой не схлопывалась.
3.Праймаза-фермент,обладающий РНК-полимеразной активностью
- ДНК-полимераза не может присоединиться к одноцепочечной матрице, так как ей нужен двуцепочечный участок(ДНК-ДНК,ДНК-РНК)
Без праймерасинтез ДНК начаться не может В каждой вилке репликации ижет независимо от того,что идет во в торой вилке
4.ДНК-полимерза альфа,которая синтезирует небольшой участок ДНК
5.ДНК-полимераза эпсилон-строит длинные цепи (лидирующую)-3'-5' 6.ДНК-полимераза дельта-строит короткие цепи-5'-3’ По цепи 3’-5’-синтез идет НЕПРЕРЫВНО
По цепи 5’-3’ прерывисто
----прерывистость связана с необходимостью построения новых праймеров,
синтезируются фрагменты оказаки, при постороении нового фрагмента Оказаки праймеры(фрагменты рнк) вырезаются,расщепляются эндонуклеазой.
7. Далее фрагменты ДНК сшиваются с помощью фермента-ЛИГАЗЫ
ИЛИ
1)Геликаза разрывает водородные связи двух цепочек, нити расплетаются и образуется репликационная вилка ( показываем указательным и безымянным пальцем ПИС – это вилка, каждый палец – нить днк!)
2)Стабилизирующие белки (SSB-белки) - фиксируют эту вилку, чтобы водородные связи не образовались снова
3)Дальше работают ДНК – полимеразы (альфа, бетта, гамма, сигма, йетта) !!НО эти ферменты не могут образовать связь между первыми двумя нуклеотидами и это за них делает фермент
– ПРАЙМАЗА (но он строит затравку и РНК – нуклеотидов – длина до 100 шт. ) Затем присоединяется полимераза – a – строит ДНК, после этого присоединяется полимераза –
йетта и доходит до цепи 5 – 3 ( до этого всё строилось по 3 – 5 цепи) и заменяется на полимеразу – сигма. Она строит праймер ( затравку) на цепи 5-3 и строит ДНК.
!!Но прирывисто!!! Тк полимераза идет только в направлении 3 – 5, то она не может повернуть обратно и синтезировать ДНК на развернувшимся участке, поэтому там образуется новая затравка.

В дальнейшем промежутки между образовавшимися фрагментами застраиваются коротким
цепями ДНК – ФРАГМЕНТЫ ОКАЗАКИ – для этого как раз ЭНДОНУКЛЕАЗЫ вырезают праймер и фермент – ЛИГАЗА достраивает на месте праймера короткую цепь ДНК.
Точка,где соседние вилки встречаются -ТОЧКА ТЕРМИНАЦИИ! Участок от точки терминации до точки терминации – РЕПЛИКОН!
Болезни при нарушении работы эндонуклеазы: Синдром Мартина – Белла – синдром ломкой X – хромосомы
|
СИНТЕЗ НА КОНЦЕВЫХ УЧАСТКАХ – ТЕЛОМЕРАХ |
|
|
1) |
Эти участки остаются не дореплицированы и чтобы информация не терялась, то здесь |
||
|
длинные повторяющиеся последовательности, которые не несут информации о структуре |
||
|
белка |
|
|
2) |
НО в СКК, первичных половых клетках и клетках эпителия есть фермент |
- ТЕЛОМЕРАЗА ( |
|
|
особенно активна в раковых клетках) , который достраивает эти участки |
|
|
|
Более развернуто ниже: |
|
|
|
Синтез теломерных участков |
|
|
|
Цепь 3’-5’(кончик хромосомы) |
|
|
|
Приходит фермент ГЕЛИКАЗА-рвет водородные связи,на каждой цепи происходит синтез |
||
|
Если кончик заканчивается на 3”-присоединяется праймер,потом днк полимераза(далее |
||
|
стандартный синтез) Если же заканчивается на 5’—теломеры. |
|
|
|
Днк теломер не содержат ген информации о структуре РНК и белков. |
|
|
|
После каждого деления размер теломерной ДНК уменьшается –механизм ограничения числа |
||
|
делений клеток |
|
|
|
Для защиты от разрушения ферментами,концевой участой заворачивается,образуя петлю |
||
|
|
|
|
|
ДЛЯ СТВОЛОВЫХ КЛЕТОК: |
Прежде чем к 3’ концу |
присоединиться |
|
праймер,присоединяется фермент_ТЕЛОМЕРАЗА |
|
|
Теломераза (синтез ДНК по матрице РНК)-фермент,обратный транскриптазе (синез рнк по матрице днк)
На основе этой рнк достраивается несколько раз одна и та же последовательность. Начинает образовываться праймер_напротив 3’-конца
Информация о хромосоме не теряется при удалении праймера,при этом из-за теломеразы хромосома удлиняется.
Благодаря такому процессу хромосома не укорачивается,а удлиняется.
Поэтому теломераза иногда выключается,для поддержагия постоянного размера теломерного района
14. Строение РНК. Транскрипция и процессинг мРНК.
РНК
РНК – нуклеиновая кислота. Представлены одноцепочечными полимерными молекулами из четырех типов рибонуклеотидов — аденинового, гуанинового, урацилового и цитозинового, в состав рибонуклеотидов входит пятиуглеродный сахар — рибоза.
РНК чаще функционируют в виде однонитевых структур, хотя они и способны образовывать двунитевые участки с использованием принципа комплементарности.
Различают несколько классов РНК:
информационные, или матричные (и-РНК), несущие генетическую информацию о строении белков;
рибосомальные ( р-РНК), входящие в состав рибосом;
транспортные (т-РНК), переносящие аминокислоты к месту синтеза белка; малые ядерные (мя-РНК), участвующие в процессе сплайсинга;
микро-РНК, регулирующие трансляцию;
piwi-РНК, участвующие в инактивации мобильных генетических элементов;
длинные некодирующие РНК с различными функциями.
