
- •Алкалоиды, производные изохинолина
- •Производные бензилизохинолина: Papaverinihydrochloridum– Папаверина гидрохлорид
- •Раствор Папаверина для инъекций:
- •Синтетические Аналоги
- •DibazolumДибазол
- •Алкалоиды, производные морфинана (фенантренизохинолина) Алкалоиды опия: морфин, кофеин, тебанин.
- •Морфина гидрохлорид Morphini hydrochloridum
- •КодеинCodeinum
- •Кодеина фосфатCodeini phosphas
- •Синтетические аналоги: Этилморфина гидрохлоридAethylmorphinihydrochloridumseuDioninum
- •ПромедолPromedolum
- •Антагонисты морфина по действию:
- •Физостигмин (эзерин)Physostigminum
- •ПрозеринProserinumseuNeostigminimethylsulfas
- •Алкалоиды группы имидазола.
- •Пилокарпин Pilocarpini hydrochloridum
- •КлофелинClophelinum
- •Алкалоиды группы пурина.
- •КофеинCoffeinum
- •ТеофиллинTheophyllinum
- •ТеоброминTheobrominum
- •Водорастворимые формы:
- •ЭуфиллинEuphyllinum
- •Алкалоиды с экзоциклическим атомом азота
- •Витамины Общая характеристика
- •4 Этапа в изучении витаминов:
- •Витамины алифатического ряда.
- •Производные эфиров глюконовой кислоты
- •Производные β-аминокислот.
- •Витамины гетероциклического ряд – производные пиридина (группаPp)
- •Антивитамины рр:
- •Оксиметилпиридиновые витамины (b6).
- •Pyridoxalphosphatum. Пиридоксальфосфат.
- •Пиримидинтиазоловые витамины (b1).
- •Эфиры тиамина и тиаминтиола.
- •Производные тиаминола не разрушаются тиаминазой.
- •Птериновые витамины (Bc).
- •Фолиновая кислота:
- •Изоаллоксазиновые витамины (в2)
- •Водорастворимые коферментные модификации рибофлавина.
- •Кобаламины (витаминыB12)
- •Cyancobolaminum(витамин в12)
- •Коферментные формы цианокобаламина.
- •Витамины, производные хромана.
- •Rutinum– рутин.
- •Оглавление:
Витамины Общая характеристика
Витамины– незаменимые для жизни организма вещества, которые не синтезируются в организме, а поступают с пищей. Являются биокатализаторами окислительно-восстановительных процессов, процессов трансаминирования, дезаминирования, декарбоксилирования. Осуществляют свою функцию в виде кофермента.
1880 – Лунин установил необходимость витаминов.
1912 – Казимир лечит болезнь Бери-Бери.
4 Этапа в изучении витаминов:
1 этап: конецXIXвека – 20 годыXXвека. Необходимые вещества для жизни содержатся в пище.
2 этап: 20-40 гг.XXвека. Из природных источников выделяют витамины и устанавливают их химическую структуру.
3 этап: 40-60 гг. ХХ века. Промышленные схемы технологии витаминов.
4 этап: с 60 гг. ХХ века. Изучение глубокой биохимической роли витаминов. Создание структурных аналогов.
Источники витаминов: растительная пища и некоторые животные продукты. В организм поступают витамины и провитамины.
Антивитамины– образуют псевдоферменты, включаются в обмен веществ и прерывают ферментативные процессы.
Классификация витаминов:
1. Буквенная
2. По растворимость
3. Химическая
а) алифатические C,B3,B15
б) алициклические A,D
в) ароматические K
г) гетероциклические B,E,P,PP
Легко участвуют в ОВР, реакция комплексообразования, люминисцентных реакциях.
ME– минимальное количество вещества, которое излечивает или предохраняет животное от авитаминоза (мг).
Витамины алифатического ряда.
Производные γ-лактонов ненасыщенных полиокисленных кислот.
Acidum ascorbinicum seu Vitaminum C
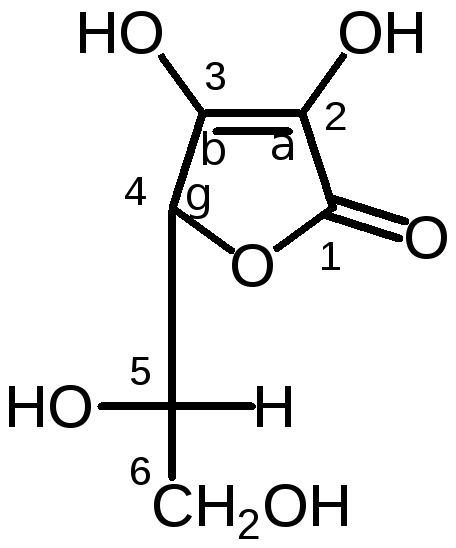
Название произошло от слова «скорбут» - цинга.
Бессонов впервые выделил витамин из сока белокачанной копусты..
Главные природные источники: плоды шиповника, салат, капуста, картофель, томаты, черная смородина, цитрусовые, крапива, хвоя.
Изомерия:
1. Цис-транс по двойной связи.
2. Оптическая – 4 ассиметрических атома. Только α(+) изомер является оптически активным.
3. «+» - вращает вправо плоскость поляризации света.
4. Два ассиметрических атома находятся рядом – трео- и эритро- изомерия. Витамин С – трео-измер.
Описание: белый кристаллический порошок без запаха, кислого вкуса.
Растворимость: ЛР в воде, спирте. ПНР в эфире, хлороформе.
Химические свойства:
Кислотные свойства: легкоподвижен водород уOHприC3(уC2– мезомерный эффект).
pKC3=4,27
pKC2=11,57
Восстановительные свойства:наличие енольной группировки.
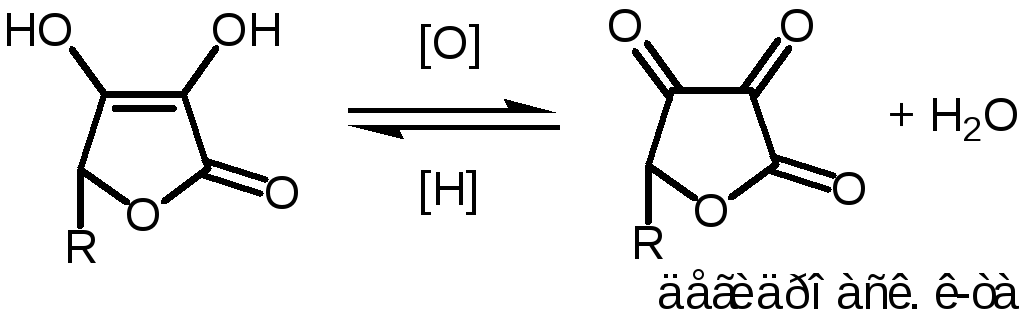
При нарушении условий хранения, особенно в растворах быстро окисляется. В щелочной или кислой среде может пойти необратимый процесс окисления:
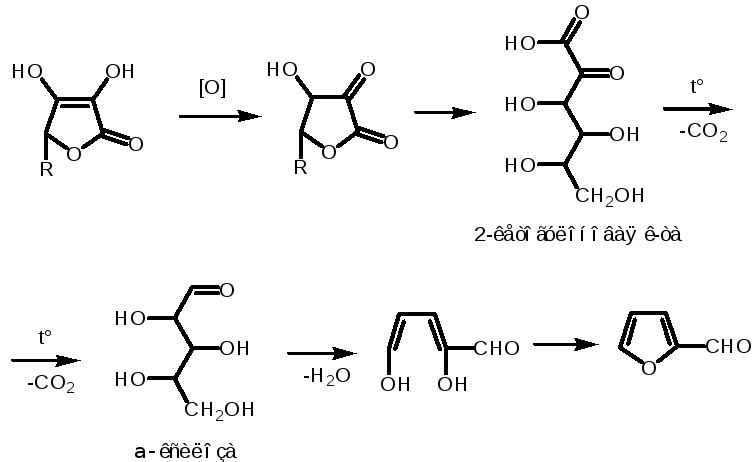
Подлинность:
ГФ:
1. С AgNO3 2%
![]()
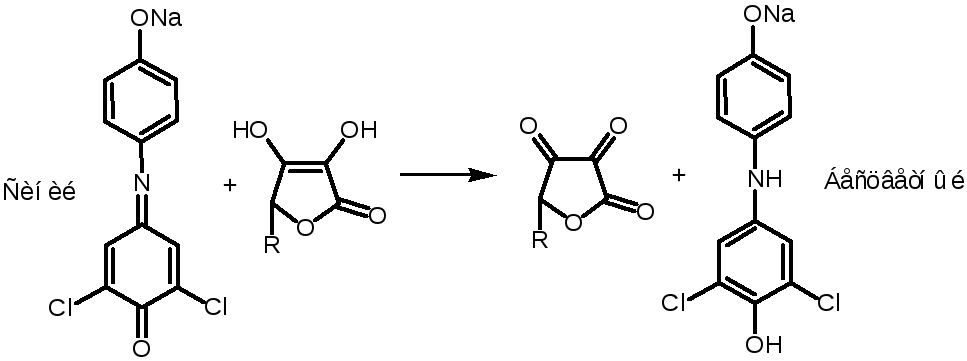
2. С Индофеноловым красителем
НеГФ:
3. С KMnO4/H+MnSO4
4. Обесцвечивание раствора I2
5. Обесцвечивание метиленового синего.
6. Получение берлинской лазури:
Аск. кислота + 2K3[Fe(CN)6] + 6HCl Окисленная кислота + 2H4[Fe(CN)6] + 6KCl
3H4[Fe(CN)6] + 4FeCl3↓Fe4[Fe(CN)6]3+ 12HCl
7. С раствором фосфорномолибденовой кислоты:
H3PO4•12MoO3•2H2O + Аск. кислотаОкисленная кислота + ↓Mo2O5•MoO2ярко-синий + H3PO4
8. С реактивом феллинга.
CuOH Cu2O кирпично-красный.
9. Реакция солеобразования с Fe2+
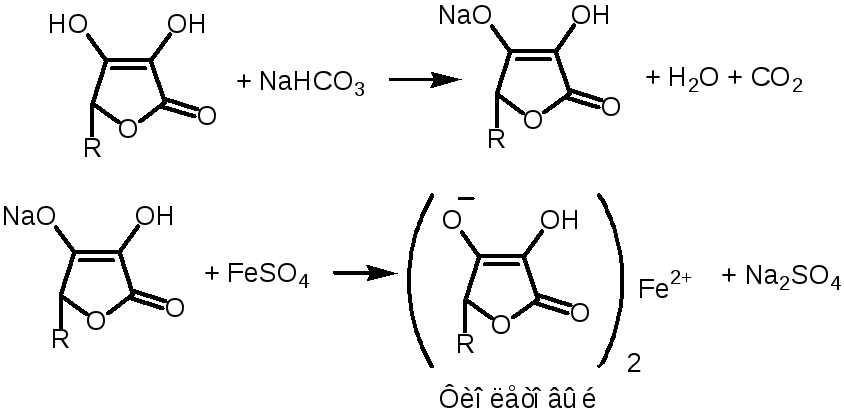
Использовать NaOHнельзя, т.к.Fe(OH)2↓ выпадет в красный осадок.
Чистота:
температура плавления, удельное вращение
![]()
Количественное определение:
1. Йодатометрия. Титрант KIO30,1М. К раствору добавляютKI,HCl. Индикатор – крахмал.
![]()
ТЭ: KIO3+ KI + HClI2
f=1/2
НеГФ:
2. Йодометрия с крахмалом или без него.
I2 2HI
3. Перманганатометрия.
4. Цериметрия.
5. Алкалиметрия. Индикатор ФФ. Титран – NaOH.
![]()
f=1
6. ФЭК с 2,6-дихлорфенолиндофенолятом.
7. СФМ.
Solutio Acidi ascorbinici 5% pro injectionibus in ampullis.
Состав на 1 л:
Аскорбиновой кислоты 50 г
NaHCO323,85 г
Na2S2O51 г илиNa2SO3– 2 г
Воды для инъекций до 1 л
NaHCO3– корректорpH(повышает до 6-7).
Na2S2O5(Na2SO3) – антиоксидант, при растворении образуетсяNaHSO3– истинный антиоксидант.
КО: Йодатометрия, но надо убратьNaHSO3, для этого добавляют 1% раствор формальдегида +HCl
H-CHO + NaHSO3
![]() HO-CH2-SO3Na
HO-CH2-SO3Na
Хранение: В хорошо укупоренной таре оранжевого стекла, в прохладном месте. Применяют для лечения и профилактики цинги, кровотечения, инфекционных заболеваний. Излишки выводятся с мочой.
