
- •3. Циклы поршневых двигателй внутреннего сгорания (двс)
- •3.1. Принцип действия двс
- •3.2. Цикл со смешанным подводом тепла
- •3.4. Термодинамика идеального цикла Дизеля
- •3.5. Индивидуальное задание по термодинамическому расчету необратимых циклов поршневых двигателей
- •3.6. Указания к выполнению задания
- •3.7. Описание программы
- •3.8. Пример выполнения задания
- •4. Газотурбинные установки
- •4.1. Гту со сгоранием при постоянном давлении
- •4.2. Цикл газотурбинной установки с подводом тепла
- •4.3. Цикл газотурбинной установки со сгоранием
- •4.4. Газотурбинная установка со сгоранием при
- •4.5. Индивидуальное задание по термодинамическому
- •4.6. Указания к выполнению задания
- •4.7. Описание программы
- •4.8. Пример выполнения задания
- •0 Дж/кгДж/кгДж/кгДж/кг.
- •5. Элементы химической термодинамики
- •5.1. Закон Гесса и его следствия
- •5.2. Зависимость теплового эффекта химической
- •5.3. Задание по расчету теплового эффекта
- •5.4. Пример расчёта
- •5.5. Закон действующих масс. Константы равновесия
- •5.6. Степень завершенности реакции и состав
- •5.7. Термодинамические уравнения процесса протекания
- •5.8. Методы расчета констант равновесия
- •Метод Темкина-Шварцмана
- •5.9. Индивидуальные задания по определению
- •5.10. Примеры выполнения заданий
5.10. Примеры выполнения заданий
Пример 1. Если нагреть 0,746 кг йода и 0,0162 кг водорода в закрытом сосуде емкостью 1 м3 до 693 К, то при достижении равновесия образуется 0,721 кг йодистого водорода. Сколько йодистого водорода получится, если к исходной смеси добавить 0,1 кг йода и 0,005 кг водорода?
|
Дано: m1 = 0,746 кг µ1 = 254·10-3 кг/моль m2 = 0,0162 кг µ2 = 2·10-3 кг/моль V = 1 м3 T = 693 К m 3= 0,721 кг µ3 = 128·10-3 кг/моль
|
|
Найти:
|
![]()
![]()
![]() .
.
Константа равновесия этой реакции, выраженная через концентрации, может быть записана в виде:
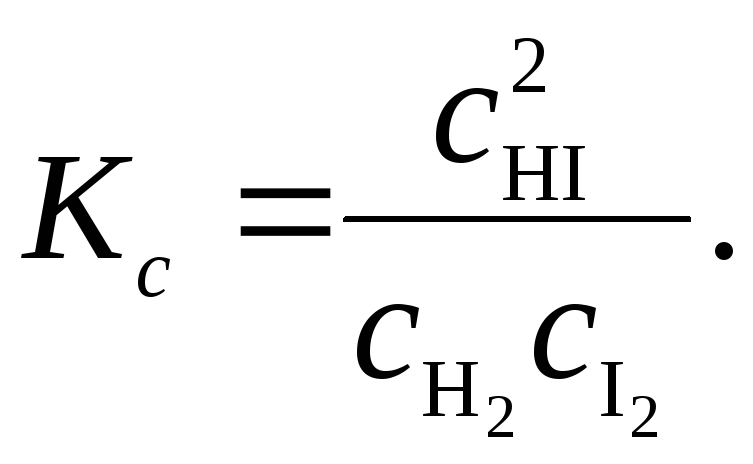 (5.43)
(5.43)
Учитывая,
что равновесная концентрация
![]() ,
где
,
где![]() –
число молей
–
число молей![]() -го
вещества в равновесной смеси, перепишем
выражение (5.43):
-го
вещества в равновесной смеси, перепишем
выражение (5.43):
 (5.44)
(5.44)
Число
молей
![]() в равновесной смеси найдем из уравнения:
в равновесной смеси найдем из уравнения:
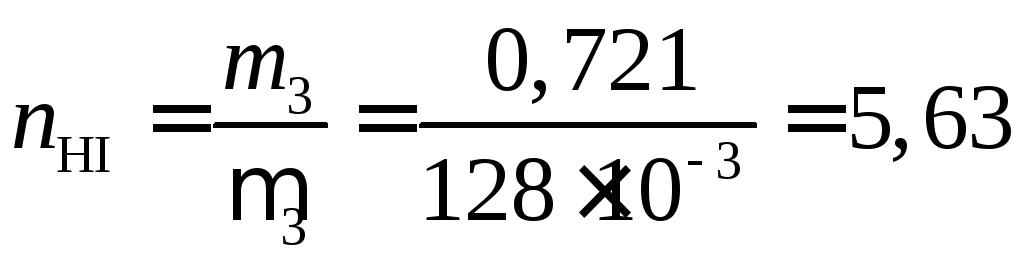 (моль).
(моль).
Найдем
число молей
![]() и
и![]() перед началом реакции:
перед началом реакции:
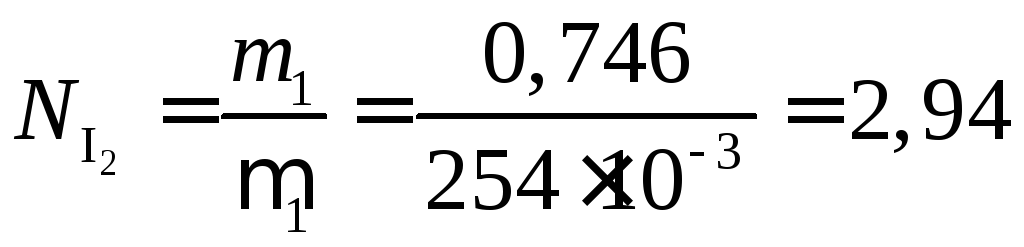 (моль);
(моль);
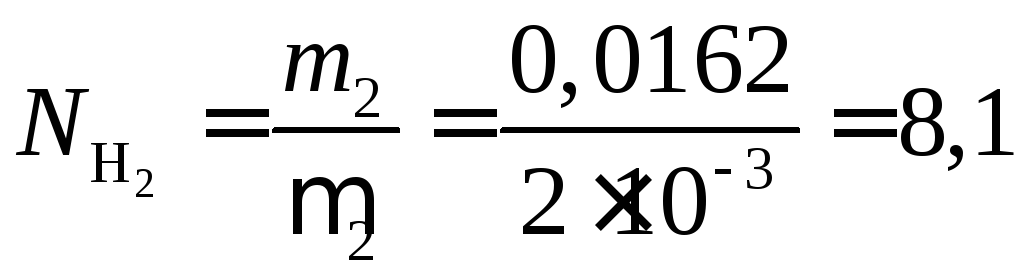 (моль).
(моль).
Реакция
протекает при постоянном объеме, поэтому
согласно уравнению реакции из 1 моль
йода и 1 моль водорода образуется
2 моль йодистого водорода, поэтому
на образование
![]() моль
йодистого водорода пойдет 2,82 моль
йода и 2,82 моль водорода. Следовательно,
в равновесной смеси останется:
моль
йодистого водорода пойдет 2,82 моль
йода и 2,82 моль водорода. Следовательно,
в равновесной смеси останется:
![]() моль
йода;
моль
йода;
![]() моль
водорода;
моль
водорода;
![]() моль
йодистого водорода.
моль
йодистого водорода.
Подставим эти значения в выражение (5.44) и определим константу равновесия:
![]() .
.
При
добавлении к исходной смеси
![]() йода и
йода и![]() водорода вновь должно установится
равновесие, но величина
водорода вновь должно установится
равновесие, но величина![]() при этом не изменится. Найдем новые
равновесные значения чисел молей всех
веществ. Обозначим новые значения
при этом не изменится. Найдем новые
равновесные значения чисел молей всех
веществ. Обозначим новые значения![]() ,
тогда новые равновесные числа молей
йода и водорода будут равны:
,
тогда новые равновесные числа молей
йода и водорода будут равны:
![]() ;
;
![]() .
.
Подставим это в (5.44) и решим уравнение:
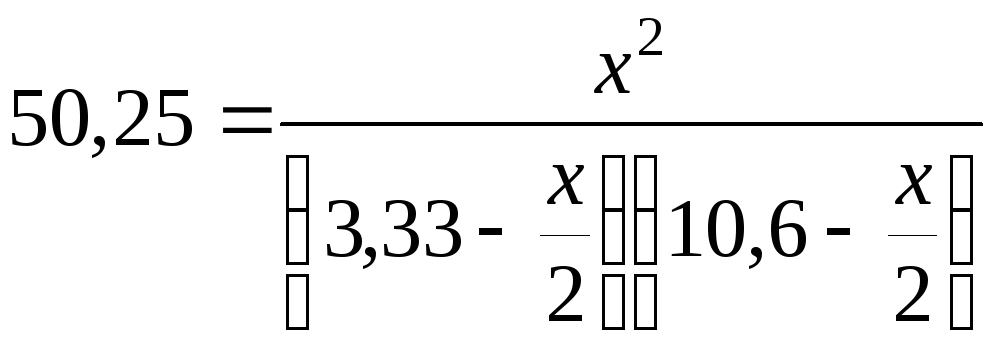 ;
;
![]() ;
;
![]() ;
;
![]() ,
,
откуда
![]() моль;
моль;![]() моль.
моль.
Первый
корень не имеет физического смысла,
т. к.
![]() может быть только меньше 10,6 моль, в
противном случае
может быть только меньше 10,6 моль, в
противном случае![]() будет
отрицательна. Таким образом, количество
йодистого водорода составит 6,45 моль
или 6,45·128·10-3
= 0,826 кг.
будет
отрицательна. Таким образом, количество
йодистого водорода составит 6,45 моль
или 6,45·128·10-3
= 0,826 кг.
Из разобранного примера видно, что увеличение концентрации исходных веществ смещает равновесие в сторону повышения концентрации конечных веществ.
Ответ:
![]() кг.
кг.
Пример
2. При 823 К и давлении 1,0133·105 Па
степень диссоциации фосгена на окись
углерода и хлор равна 77 %. Определить
значения
![]() и
и![]() .
.
|
Дано: T = 823 К P = 1,0133·105 Па
|
|
Найти:
|
![]() .
.
Константа равновесия, выраженная через
парциальные давления, будет иметь вид:
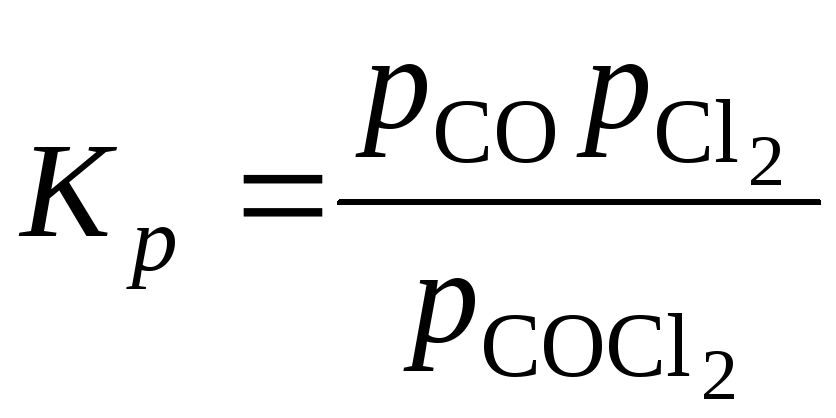 .
(5.45)
.
(5.45)
Парциальное давление представим как произведение общего давления на мольную долю данного компонента:
![]() ;
;
![]() ;
;![]() ,
(5.46)
,
(5.46)
где
![]() – суммарное число молей всех компонентов
в равновесной смеси.
– суммарное число молей всех компонентов
в равновесной смеси.
Подставим (5.46) в (5.45):
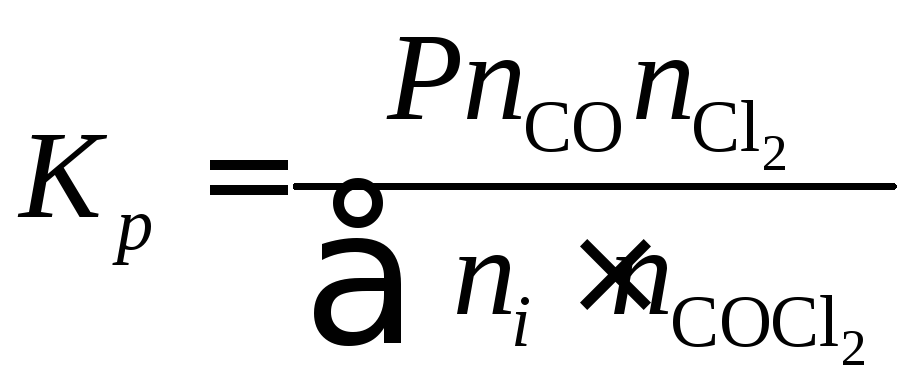 .
(5.47)
.
(5.47)
Числа молей компонентов в равновесной смеси найдем по формуле:
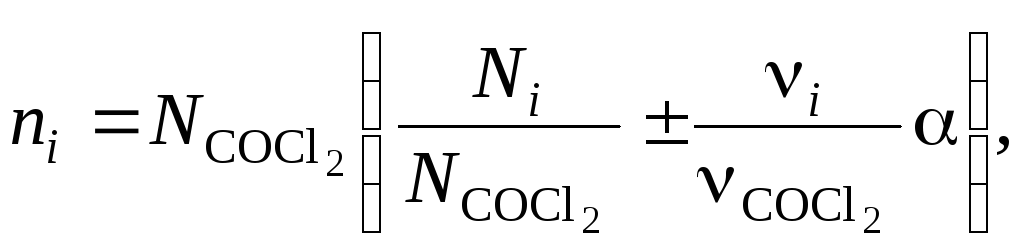 (5.48)
(5.48)
где
![]() – число молей
– число молей![]() -го
компонента в исходной смеси;
-го
компонента в исходной смеси;![]() – стехиометрический коэффициент
– стехиометрический коэффициент![]() -го
компонента в уравнении реакции.
-го
компонента в уравнении реакции.
Знак «+» относится к продуктам реакции, знак «–» к исходным веществам.
Учитывая,
что перед началом реакции
![]() и
и![]() отсутствовали,
т. е.
отсутствовали,
т. е.![]() ,
а число молей
,
а число молей![]() равно стехиометрическому количеству
(
равно стехиометрическому количеству
(![]() моль),
получим из (5.48):
моль),
получим из (5.48):
![]() ;
;
![]() ;
;![]() ;
;
![]() .
(5.49)
.
(5.49)
Подставим (5.49) в (5.47):
![]() .
.
Подставим численные значения:
![]() (Па).
(Па).
Константу равновесия, выраженную через концентрации, найдем из уравнения:
![]() ,
,
где
![]() – изменение стехиометрических
коэффициентов.
– изменение стехиометрических
коэффициентов.
Следовательно,
![]() моль/м3.
моль/м3.
Ответ:
![]() Па;
Па;![]() моль/м3.
моль/м3.
Пример
3. В реакции
![]() при
начальном давлении водяного пара
1,3325·105 Па
после достижения равновесия при 473 К
парциальное давление образовавшегося
водорода равнялось 1,2717·105 Па.
Определить выход водорода, если в
сосуд объемом 2·10-3 м3,
содержащий металлическое железо, ввести
водяной пар под давлением 3,0399·105 Па
при 473 К.
при
начальном давлении водяного пара
1,3325·105 Па
после достижения равновесия при 473 К
парциальное давление образовавшегося
водорода равнялось 1,2717·105 Па.
Определить выход водорода, если в
сосуд объемом 2·10-3 м3,
содержащий металлическое железо, ввести
водяной пар под давлением 3,0399·105 Па
при 473 К.
|
Дано:
T = 473 К
|
|
Найти:
|
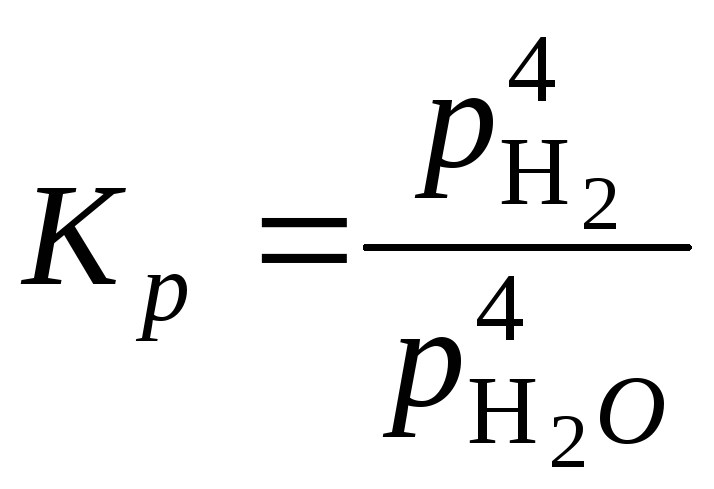 или
или
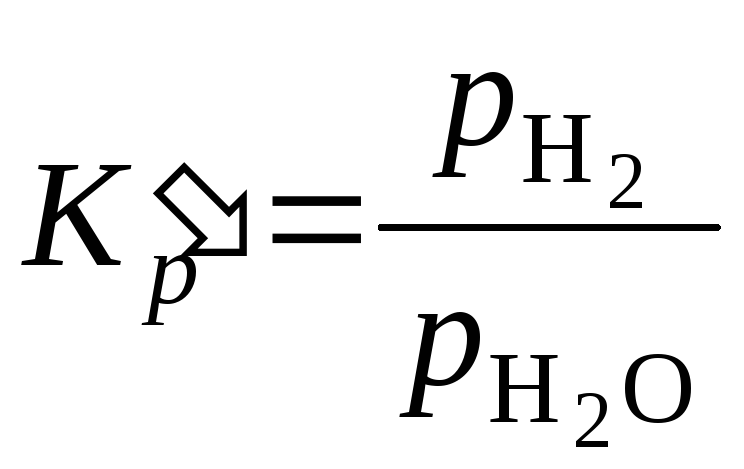 .
(5.50)
.
(5.50)
Реакция по условию идет без изменения объема, поэтому из закона Дальтона при достижении равновесия парциальное давление водяного пара будет равно:
![]() Па;
Па;
![]() Па.
Па.
Подставим эти значения в (5.50) и найдем
![]() .
.
Количество молей получившегося водорода во втором случае:
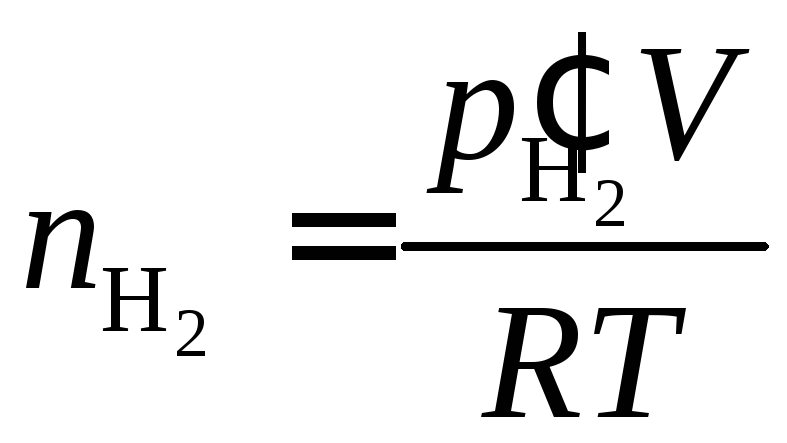 ,
(5.51)
,
(5.51)
где
![]() – парциальное давление водорода при
равновесии, которое равно:
– парциальное давление водорода при
равновесии, которое равно:
![]() ,
(5.52)
,
(5.52)
где
![]() – парциальное давление водяного пара
при равновесии, равное:
– парциальное давление водяного пара
при равновесии, равное:
![]() .
(5.53)
.
(5.53)
Подставим
(5.53) в (5.52) и выразим
![]() :
:
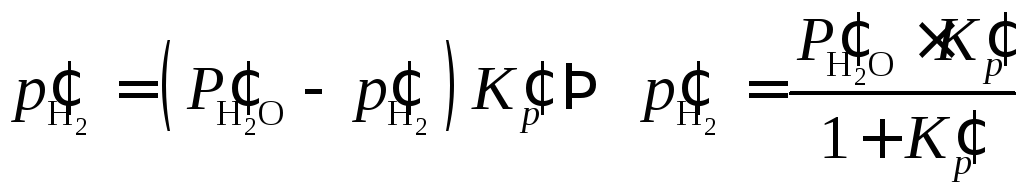 .
.
Сделаем численный расчет:
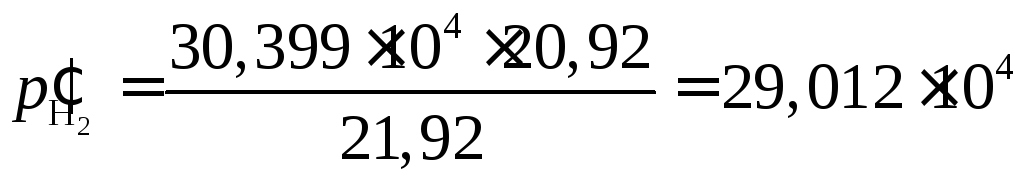 Па.
Па.
Массу
образовавшегося водорода найдем, умножив
число молей
![]() на
молярную массу
на
молярную массу![]() кг/моль:
кг/моль:
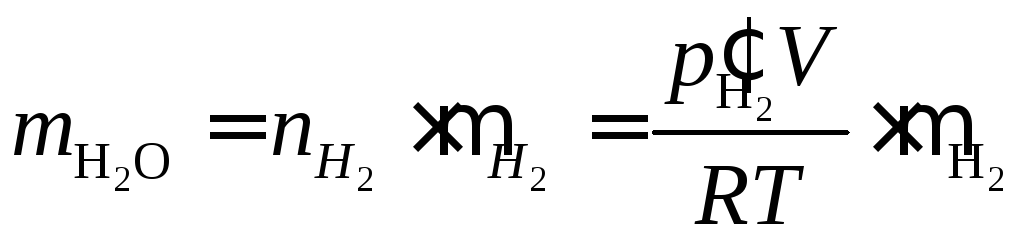 ;
;
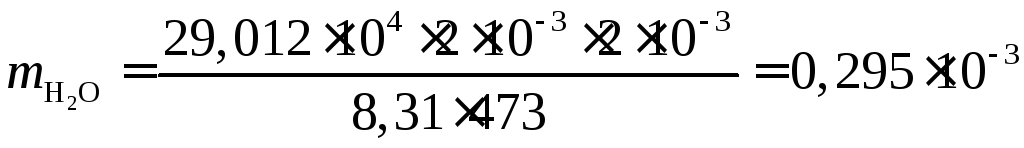 кг.
кг.
Ответ:
![]() г.
г.
Пример 4. Определить стандартное сродство водорода к кислороду при T = 1000 К, если известно, что степень диссоциации водяного пара при этой температуре под давлением 1,0133·105 Па равна 7·10-7.
|
Дано: T = 1000 К
|
|
Найти:
|
![]() ,
,
где
![]() – константа равновесия данной реакции,
выраженная в атмосферах, величину
которой определим по известной степени
диссоциации водяного пара:
– константа равновесия данной реакции,
выраженная в атмосферах, величину
которой определим по известной степени
диссоциации водяного пара:
![]() .
.
Если исходить из 1 моля H2O, то в равновесной смеси будет следующие количества H2O, H2 и O2:
![]() ;
;
![]() ;
;![]() .
.
Общее число молей в равновесной смеси:
![]() (моль).
(моль).
Тогда парциальные давления компонентов:
 ;
;
![]() ;
;![]() .
.
Отсюда
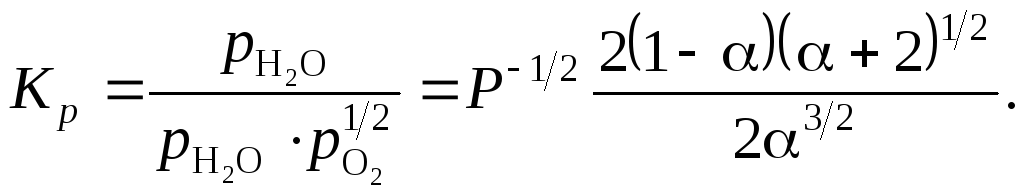
Найдем
значение
![]() ,
учитывая, чтор
= 1 атм.:
,
учитывая, чтор
= 1 атм.:
![]() (атм.-1/2).
(атм.-1/2).
Тогда стандартное сродство будет равно:
![]() Дж/моль.
Дж/моль.
Ответ:
![]() Дж/моль.
Дж/моль.
|
Дано: T1 = 600 К
Т2 = 298 К |
|
Найти:
|
Решение. Так как температурный интервал велик, пренебрегать зависимостью теплового эффекта реакции от температуры нельзя. Эту зависимость можно получить из закона Кирхгофа:
![]() .
.
Зависимости
теплоемкостей веществ, участвующих в
реакции, от температуры
![]() находим по П2.9:
находим по П2.9:
Таблица 5.8
|
Вещество |
Зависимость
теплоемкости от температуры
| ||
|
a |
b |
| |
|
CO2 |
44,14 |
9,04 |
–8,54 |
|
H2 |
27,28 |
3,26 |
0,50 |
|
CO |
28,41 |
4,10 |
–0,46 |
|
H2O(г) |
30,00 |
10,71 |
0,33 |
Находим

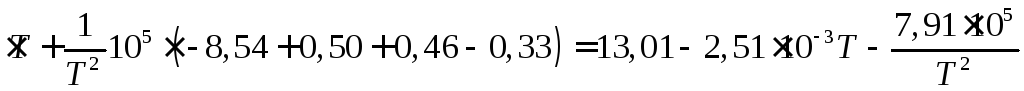 .
.
Следовательно,
![]() .
.
![]() находим
по табл. 9 [14].
находим
по табл. 9 [14].
![]() кДж/моль.
кДж/моль.
![]()

![]() ;
;
Согласно
уравнению изобары
![]() ,
получим
,
получим
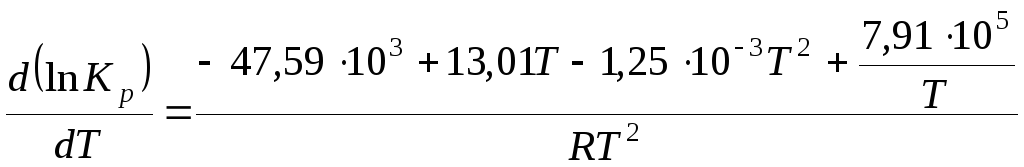 ;
;
![]() ;
;
![]() .
.
Постоянную интегрирования В можно найти по известному значению константы равновесия при Т2 = 298 К:
![]() .
.
Подставим
это значение константы интегрирования
в ранее полученное нами уравнение
зависимости
![]() от температуры:
от температуры:
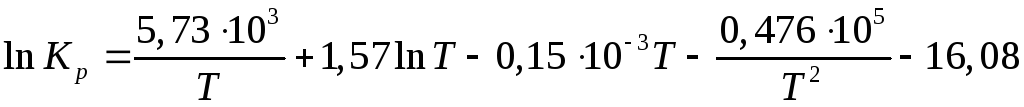 .
.
Найдем
![]() при
при![]() К:
К:
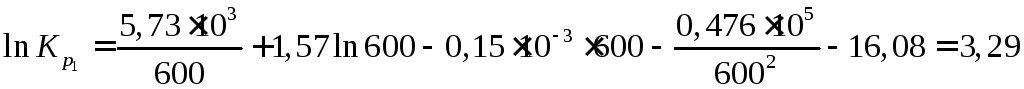 .
.
Отсюда
![]() =26,87.
=26,87.
Ответ:
![]() =26,87.
=26,87.
ЛИТЕРАТУРА
Основная
Исаев, С.И. Термодинамика [Текст]: Учебник для вузов/ С.И. Исаев. Изд-во 3-е, перераб. и доп. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2000.– 416 с.
Кудинов, В.А. Техническая термодинамика [Текст]: Учебное пособие / В.А. Кудинов; Э.М. Карташов. – Изд-во 2-е исправл. – М.: Высш. шк., 2001.– 261 с.
Ерофеев, В.Л. Теплотехника [Текст]: Учебник / В.Л. Ерофеев; П.А. Пряхин. – М.: ИКЦ «Академкнига», 2006.– 488 с.
Александров, А.А. Термодинамические основы циклов теплоэнергетических установок [Текст]: Учебное пособие / А.А. Александров. – М.: Изд-во МЭИ, 2004.– 158 с.
Прибытков, И.А. Теоретические основы теплотехники [Текст]: Учебник / И.А. Прибытков; Под ред. И.А. Прибытков; И.А. Левицкий. – М.: Изд.центр «Академия» 2004.– 464 с.
Теплотехника [Текст]:Учебник / Под ред. В.Н. Луканина. – М.: Высш. шк., 2000.– 671 с.
Дополнительная
Юдаев, Б.Н. Техническая термодинамика. Теплопередача / Б.Н. Юдаев. – М.: Высшая школа, 1988.– 475 с.
Рабинович, О.М. Сборник задач по технической термодинамике. – М.: Машиностроение, 1969.– 240 с.
Ривкин, С.Л. Термодинамические свойства газов. – М.: Энергоатомиздат, 1987.– 287 с.
Кузовлев, В.А. Техническая термодинамикаи основы теплопередачи [Текст]: Учебное пособие / В.А. Кузовлев. Под ред. Л.Р. Стоцкого. 2-е изд., перераб. и доп. – М.: Высш. Шк. 1983.– 335 с.
Нащокин, В.В. Техническая термодинамика и теплоотдача. – М.: Высшая школа, 1980.– 496 с.
Энергетические расчеты технических систем [Текст]:Справочное пособие / В.М. Бродянский. – Киев.: Наукова думка, 1991.– 360 с.
Техническая термодинамика [Текст] / Учебник для вузов под ред. В.И. Крутова. – М.: Высшая школа, 1981.– 439 с.
Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Понамаревой. – Л.: Химия, 1983.– 232 с.
Сборник задач по технической термодинамике [Текст]: Учебное пособие / Т.Н. Андрианов, Б.В. Дзамнев, В.Н. Зубарев, С.А. Ремецев. – М.: Энергоиздат, 1981.– 240 с.
