
- •3. Циклы поршневых двигателй внутреннего сгорания (двс)
- •3.1. Принцип действия двс
- •3.2. Цикл со смешанным подводом тепла
- •3.4. Термодинамика идеального цикла Дизеля
- •3.5. Индивидуальное задание по термодинамическому расчету необратимых циклов поршневых двигателей
- •3.6. Указания к выполнению задания
- •3.7. Описание программы
- •3.8. Пример выполнения задания
- •4. Газотурбинные установки
- •4.1. Гту со сгоранием при постоянном давлении
- •4.2. Цикл газотурбинной установки с подводом тепла
- •4.3. Цикл газотурбинной установки со сгоранием
- •4.4. Газотурбинная установка со сгоранием при
- •4.5. Индивидуальное задание по термодинамическому
- •4.6. Указания к выполнению задания
- •4.7. Описание программы
- •4.8. Пример выполнения задания
- •0 Дж/кгДж/кгДж/кгДж/кг.
- •5. Элементы химической термодинамики
- •5.1. Закон Гесса и его следствия
- •5.2. Зависимость теплового эффекта химической
- •5.3. Задание по расчету теплового эффекта
- •5.4. Пример расчёта
- •5.5. Закон действующих масс. Константы равновесия
- •5.6. Степень завершенности реакции и состав
- •5.7. Термодинамические уравнения процесса протекания
- •5.8. Методы расчета констант равновесия
- •Метод Темкина-Шварцмана
- •5.9. Индивидуальные задания по определению
- •5.10. Примеры выполнения заданий
5.2. Зависимость теплового эффекта химической
реакции от температуры
Изменение теплового эффекта химической реакции в зависимости от температуры выражается законом Кирхгофа, который устанавливает, что температурный коэффициент теплового эффекта изохорной реакции равен разности суммарных изохорных теплоемкостей продуктов реакции и исходных веществ, а температурный коэффициент теплового эффекта изобарной реакции равен разности суммарных изобарных теплоемкостей продуктов реакции и исходных веществ:
![]() ;
;
![]() .
(5.6)
.
(5.6)
Уравнение закона Кирхгофа в интегральной форме в общем виде:
![]()
![]() ,
(5.7)
,
(5.7)
где Q1 и Q2 – тепловой эффект реакции при температурах Т1 и Т2 соответственно.
Этот закон даёт возможность вычислять тепловые эффекты реакций при любых температурах, если известны зависимости теплоёмкостей исходных веществ и продуктов реакции от температуры и тепловой эффект реакции при какой-либо температуре.
Приняв зависимость теплоёмкости от температуры в виде
![]() ,
(5.8)
,
(5.8)
из уравнения закона Кирхгофа получим:
![]() ,
(5.9)
,
(5.9)
где Q0 = const – постоянная интегрирования,
![]() ;
;
 ;
;
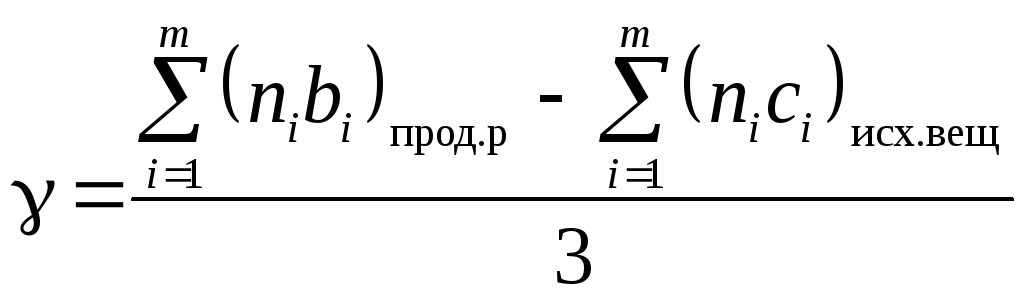 ;
;
![]()
![]() .
.
Значения постоянной интегрирования Q0 определяется по полученному опытному тепловому эффекту при одной какой-либо температуре.
Уравнение закона Кирхгофа (5.9) справедливо только в том интервале температур, для которого имеют место эмпирические зависимости для теплоёмкостей веществ, участвующих в реакции. Значения коэффициентов берутся из справочников.
Если известен тепловой эффект реакции при какой-либо температуре Т1, то тепловой эффект реакции при любой другой температуре можно определить из уравнения:
![]() .
(5.10)
.
(5.10)
Это соотношение имеет большое практическое значение, т. к. с его помощью можно подсчитать тепловой эффект реакции для таких условий, при которых экспериментально его определить трудно или невозможно.
Если в температурном интервале, в котором производится интегрирование уравнений, происходит фазовое превращение, то интегрирование следует производить от температуры Т1 до температуры фазового превращения, затем прибавить тепловой эффект фазового превращения при этой температуре и далее интеграл от температуры фазового превращения до заданной температуры Т2.
Важное значение для практики имеет также уравнение для подсчета теплового эффекта реакций по значениям средних теплоемкостей, изменением которых в небольших интервалах температур можно пренебречь:
![]() откуда
откуда
![]() (5.11)
(5.11)
где С1, С2, ΔС – средние суммарные мольные теплоемкости исходных веществ и продуктов реакции в пределах температур от Т1 до T2, соответственно и их приращение.
5.3. Задание по расчету теплового эффекта
химической реакции
1. Выразить уравнением зависимости теплового эффекта реакции А (табл. 5.1) в Дж/моль от температуры.
2. Вычислить тепловой эффект реакции при температуре Т1.
3. Построить графики зависимостей:
![]()
![]()
![]() в
интервале температур от 298 К до Т1.
Определить графически
в
интервале температур от 298 К до Т1.
Определить графически
![]() при
температуреТ2.
при
температуреТ2.
4.
Рассчитать
![]() при температуреТ2.
Расчёт производить двумя способами: по
средней теплоёмкости и теплоёмкости,
зависящей от температуры.
при температуреТ2.
Расчёт производить двумя способами: по
средней теплоёмкости и теплоёмкости,
зависящей от температуры.
Таблица 5.1
|
№ варианта |
Уравнение реакции А |
Т1, К |
Т2, К |
|
1 |
2Н2+СО = СН3(ОН) (г) |
390 |
350 |
|
2 |
4НСl+O2 = 2H2O (г)+2Cl2 |
750 |
650 |
|
3 |
2N2+6H2O (г) = 4 NH3+3O2 |
1300 |
1000 |
|
4 |
4NO+6H2O (г) = 4NH3+5O2 |
1000 |
900 |
|
5 |
2NO2 = 2NO+O2 |
700 |
500 |
|
6 |
N2O4 = 2NO2 |
400 |
350 |
|
7 |
Mg(OH)2 = MgO+H2O |
320 |
310 |
Окончание табл.5.1
|
8 |
CaCO3 = CaO+CO2 |
1000 |
700 |
|
9 |
Ca(OH)2 = CaO+H2O |
370 |
340 |
|
10 |
1/2S2+2H2O = SO2+2H2 |
1000 |
900 |
|
11 |
1/2S2+2CO = SO2+2CO |
900 |
850 |
|
12 |
2SO2+O2 = 2SO3 |
700 |
600 |
|
13 |
SO2+Cl2 = SO2Cl2 |
400 |
300 |
|
14 |
CO+3H2 = CH4+H2О |
1000 |
900 |
|
15 |
2CO+SO2 = 1/2S2+2CO2 |
900 |
700 |
|
16 |
CO+Cl2 = COCl2 |
400 |
350 |
|
17 |
CO2+H2 = CO+H2O |
1200 |
1000 |
|
18 |
2CO2 = 2CO+O2 |
700 |
500 |
|
19 |
CH4+CO2 = 2CO+2H2 |
350 |
320 |
|
20 |
CO2+4H2 = CH4+2H2O |
1000 |
900 |
|
21 |
C2H6 = C2H4+H2O |
400 |
350 |
|
22 |
C2H5OH = C2H4+H2O |
400 |
300 |
|
23 |
CH3CHO+H2 = C2H5OH |
500 |
450 |
|
24 |
C6H6+3H2 = C6H12 |
600 |
500 |
