
- •3. Циклы поршневых двигателй внутреннего сгорания (двс)
- •3.1. Принцип действия двс
- •3.2. Цикл со смешанным подводом тепла
- •3.4. Термодинамика идеального цикла Дизеля
- •3.5. Индивидуальное задание по термодинамическому расчету необратимых циклов поршневых двигателей
- •3.6. Указания к выполнению задания
- •3.7. Описание программы
- •3.8. Пример выполнения задания
- •4. Газотурбинные установки
- •4.1. Гту со сгоранием при постоянном давлении
- •4.2. Цикл газотурбинной установки с подводом тепла
- •4.3. Цикл газотурбинной установки со сгоранием
- •4.4. Газотурбинная установка со сгоранием при
- •4.5. Индивидуальное задание по термодинамическому
- •4.6. Указания к выполнению задания
- •4.7. Описание программы
- •4.8. Пример выполнения задания
- •0 Дж/кгДж/кгДж/кгДж/кг.
- •5. Элементы химической термодинамики
- •5.1. Закон Гесса и его следствия
- •5.2. Зависимость теплового эффекта химической
- •5.3. Задание по расчету теплового эффекта
- •5.4. Пример расчёта
- •5.5. Закон действующих масс. Константы равновесия
- •5.6. Степень завершенности реакции и состав
- •5.7. Термодинамические уравнения процесса протекания
- •5.8. Методы расчета констант равновесия
- •Метод Темкина-Шварцмана
- •5.9. Индивидуальные задания по определению
- •5.10. Примеры выполнения заданий
5.6. Степень завершенности реакции и состав
равновесной смеси
В общем случае система в состоянии химического равновесия представляет собой равновесную смесь. Количественное соотношение между веществами в равновесной смеси определяется константой равновесия, которая также определяет степень завершенности реакции. Чем больше K, тем больше в равновесной смеси будет веществ, находящиеся в правой части уравнения реакции. При K ∞ в равновесной смеси будут только продукты реакции, следовательно, реакция завершена полностью.
Степень завершенности реакции может быть выражена одной из следующих характеристик: мерой реакции, степенью превращения и степенью диссоциации.
Мера реакции
![]() ,
(5.22)
,
(5.22)
где ni и Ni – число молей вещества i в равновесной и в исходной смеси перед реакцией; i – стехиометрические коэффициенты. Отсюда число молей i-го вещества в равновесной смеси:
![]() (5.23)
(5.23)
Степень превращения представляет собой долю любого реагента, например, A (составляющая, находящаяся в левой стороне уравнения реакции), которая превращается к моменту достижения равновесия при данных условиях. Если степень превращения вещества A обозначить xA, то
![]() .
.![]() (5.24)
(5.24)
Из
соотношения
![]() ,
,
и![]() меем
меем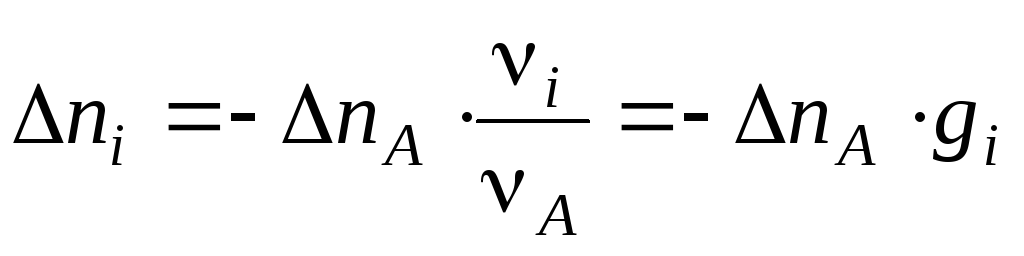 ,
где
,
где![]() .
.
Знак «минус» свидетельствует о том, что количество вещества A уменьшается: nA 0. Если бы степень превращения рассматривали в отношении вещества, находящегося в правой части уравнения реакции (например D), то знак был бы положительным, ибо для этого вещества nD 0.
Подставляя ni в уравнение (5.23) и учитывая, что nA 0 , запишем
![]() ,
(5.25)
,
(5.25)
где
![]()
Степень
диссоциации
![]() представляет собой долю вещества
(например веществаЕ),
которая продиссоциировала к моменту
равновесия:
представляет собой долю вещества
(например веществаЕ),
которая продиссоциировала к моменту
равновесия:
![]() .
(5.26)
.
(5.26)
При
реакции диссоциации левая часть уравнения
реакции имеет один член: E
– диссоциирующее вещество. Следовательно,
![]() =хe.
Поэтому по аналогии с (5.25) число молей
любой составляющей i
в равновесной смеси
=хe.
Поэтому по аналогии с (5.25) число молей
любой составляющей i
в равновесной смеси
![]() ,
(5.27)
,
(5.27)
где
![]() .
.
Величины , xA и α, выражающие степень завершенности реакции, связаны между собой:
![]() ,
(5.28)
,
(5.28)
![]() (5.29)
(5.29)
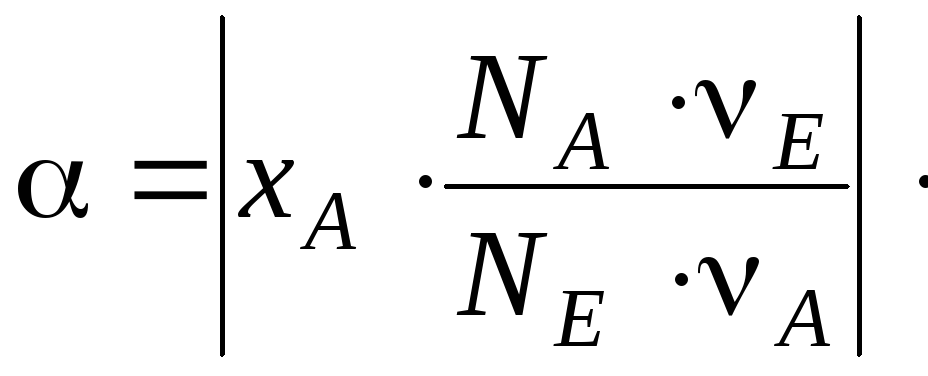 (5.30)
(5.30)
5.7. Термодинамические уравнения процесса протекания
химических реакций
Величину изменения изобарного потенциала (энергии Гиббса) при термодинамически обратимом протекании химической реакции
![]() ,
,
можно вычислить по уравнению изотермы:
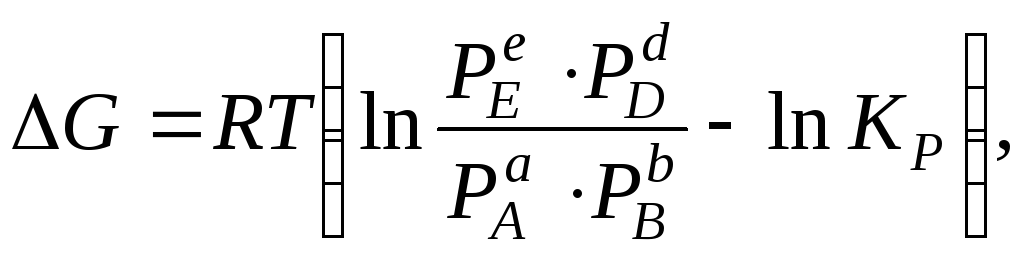 (5.31)
(5.31)
где P – величина парциального давления в неравновесном состоянии.
При изохорном протекании химической реакции величина изменения изохорно-изотермического потенциала (энергии Гельмгольца) также может быть вычислена по уравнению изотермы:
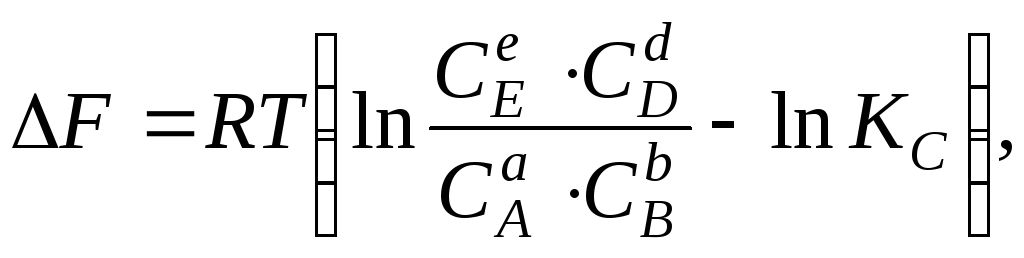 (5.32)
(5.32)
где С – концентрация веществ в неравновесном состоянии.
Если G или F меньше нуля, то реакция самопроизвольно может протекать в прямом направлении; если G или F больше нуля – в обратном направлении; если G или F равны нулю, система находится в равновесии.
Способность различных химических реакций к самопроизвольному их протеканию сопоставляют друг с другом при стандартных условиях исходной смеси. За стандартные принимают условия, когда концентрации исходных веществ и конечных продуктов в начале реакции равны 1 кмоль/м3 или парциальное давление каждого компонента равно 1 физической атмосфере. В таком случае уравнения изотермы химической реакции могут быть представлены в виде:
![]() ;
;
![]() .
(5.33)
.
(5.33)
Если парциальные давления и KP выражать в Паскалях, то:
![]()
или
![]() (5.34)
(5.34)
Изменение изобарного (или изохорного) потенциала при протекании химической реакции равно разности между алгебраическими суммами G (или F) образования конечных продуктов и начальных веществ:
![]()
![]() .
(5.35)
.
(5.35)
Зная изменение изобарного или изохорного потенциала реакции в стандартных условиях, можно определить константы равновесия по уравнениям (5.33).
Зависимость константы химического равновесия от температуры описывается уравнениями изобары и изохоры. В дифференциальном виде эти уравнения можно записать:
![]() и
и
![]() .
(5.36)
.
(5.36)
Отсюда следует, что с повышением температуры константа равновесия увеличивается в процессах, сопровождающихся поглощением теплоты (Q > 0), т. е. в эндотермических процессах. В экзотермических реакциях (т. е. когда Q < 0) константа равновесия при понижении температуры увеличивается.
В общем случае влияние на изменение химического равновесия различных факторов (главным образом, Т и Р) подчиняется принципу смещения равновесия (принцип Ле-Шателье-Брауна): внешнее воздействие, выводящее систему из состояния равновесия, вызывает в системе процессы, стремящиеся ослабить эффект этого воздействия.
В простейшем случае можно принять, что в небольшом интервале температур величина теплового эффекта реакции не зависит от температуры. Тогда получим
![]() (5.37)
(5.37)
где В – постоянная интегрирования.
Если же интегрирование приходится производить в значительном интервале температур, то необходимо по закону Кирхгофа вывести уравнение зависимости теплового эффекта реакции от температуры, подставить это уравнение вместо H или U в уравнение (5.36) и провести интегрирование. В результате получается:
![]() ;
(5.38)
;
(5.38)
![]() ,
,
г![]() деa,
b,
c
– коэффициенты в зависимости теплоемкостей
от температуры (C
= a
+ bT
+ cT
2).
деa,
b,
c
– коэффициенты в зависимости теплоемкостей
от температуры (C
= a
+ bT
+ cT
2).
