
книги из ГПНТБ / Глембоцкий В.А. Флотация учебник
.pdfКак показали опыты, при сильном окислении галенита, обрабо танного перекисью водорода, скорость формирования адсорбцион-- ного слоя собирателей (бутилксантогената и олеата натрия) на его поверхности уменьшается в несколько раз. Этими же опытами пока зано, что отрицательное влияние сильного окисления сульфида на его взаимодействие с собирателем зависит от природы собирателя. Так, например, если для слабоокисленного галенита бутиловый ксантогенат оказывается более сильным собирателем, чем олеат натрия^ то с увеличением степени окисленности этого сульфида указанные собиратели как бы меняются местами, и, хотя скорость взаимодей ствия минерала снижается для обоих собирателей, олеат натрия становится более сильным реагентом по сравнению с бутиловым ксантогенатом. Это связано с различием физико-химических усло вий взаимодействия сульфгидрильного собирателя и карбок
сильного |
с более длинной углеводородной цепью, происходя |
||
щего на |
качественно |
отличных поверхностях сульфида, и раз |
|
личиями |
в составе |
продукта |
окисления, образующегося на |
нем. |
|
|
|
Поскольку поверхность минерала неоднородна, то различные |
|||
участки |
ее реагируют |
с кислородом |
по-разному: наиболее активные |
в хемоадсорбционном отношении точки сульфидной поверхности могут успеть за короткое время пройти все стадии окисления — вплоть до образования пленки сульфата, в то время как менее ак тивные к этому моменту пройдут только стадию физической адсорб ции кислорода. В соответствии с этим будет изменяться активность поверхности к собирателю и ее гидратированность в различных участках. Конечные результаты будут определяться суммарным воз действием кислорода воды и собирателя.
В соответствии с гипотезой Д. А. Шведова [243] сульфиды могут образовы вать с кислородом ряд соединений, которые по своему составу являются проме жуточными между сульфидом и сульфатом. Эти соединения (их можно предста вить как mPbS X п PbSO,j), названные Д. А. Шведовым сульфидо-сульфатами, прочно связаны с кристаллической решеткой минерала своей сульфидной груп пой и вместе с тем адсорбционно активны по отношению к собирателю благодаря своей сульфатной группе (которая может замещаться анионом собирателя).
Неизмененный сульфид не взаимодействует с собирателем вследствие весьма малого произведения растворимости. Сульфат способен к такому взаимо действию, но, будучи продуктом полного окисления, легко отслаивается от ча стицы минерала (при полном окислении внешних слоев решетки сульфида она разрушается). Гипотеза предполагает также необходимость осернения (сульфидизации) поверхности окисленных минералов для успешной их флотации. При сульфидизации сульфатов они превращаются с поверхности в сульфидо-суль- фаты. Карбонаты образуют аналогичные соединения — сульфидо-карбонаты. Ввиду этого те и другие окисленные минералы начинают хорошо флоти ровать после их сульфидизации.
Заслугой Д. А. Шведова является то, что он был одним из первых, кто обратил внимание обогатителей на поверхностные соединения и указал на их важную роль в процессе взаимодействия минералов с реагентами при флотации. Однако гипотеза Д. А. Шведова не вскрывает многосторонней роли кисло рода как реагента, активирующего взаимодействие минерала с собира телями.
86
П р о ч н о с т ь |
з а к р е п л е н и я |
р е а г е н т о в - |
|
с о б и р а т е л е й |
н а п о в е р х н о с т и |
м и н е р а л а |
|
Под прочностью закрепления собирателя понимается величина энергии связи между адсорбционным реагентом и кристаллической решеткой минерала.
Установлено, что прочность закрепления собирателя на минера лах с одинаковым катионом и различными анионами неодинакова. Так, например, прочность закрепления аниона ксантогената на церуссите (PbCOg) ниже, чем на галените (PbS).
Ввиду большого удельного значения ионной связи у церуссита (вследствие наличия в нем карбонатного аниона) по сравнению с га ленитом церуссит гидратирован в несравненно большей степени, чем галенит. По-видимому, вследствие этого высокоустойчивые гидратные слои на церуссите должны ослаблять связь ксантогената на поверхности минерала, поэтому закрепление собирателя на церус сите будет менее прочным, чем на галените. *
А. М. Годэн установил различную прочность закрепления ксан тогената на халькозине и малахите. Ксантогенат, закрепившийся на малахите, легко удаляется с его поверхности действием органиче ских растворителей (бензолом, ацетоном, эфиром), а ксантогенат, закрепившийся на халькозине, практически не удаляется с его по верхности (после действия в определенных условиях органических растворителей на халькозине остается 96% ксантогената от перво начально закрепившегося количества). Органические растворители (бензол, ацетон и др.) хорошо растворяют образовавшиеся в объеме раствора ксантогенаты тяжелых металлов, но в случае халькозина практически не переводят в раствор ксантогенат меди с поверхности халькозина, а переводят этот ксантогенат в раствор с поверхности малахита.
Прочность закрепления ксантогенатов и других анионных собира телей на поверхности минералов, как правило, весьма значительна. Это подтверждается не только невозможностью добиться в отдель ных случаях полного снятия с поверхности минерала закрепившихся на ней собирателей, но также и дугами данными. Так, известно, что только сравнительно ограниченное число анионов (например, гидроксил и карбонат-ионы) могут вытеснять с поверхности минерала закрепившиеся анионы ксантогената. При этом требуется создать в растворе достаточно высокую концентрацию этих ионов.
Если учесть неоднородность поверхности минералов, то станет понятно, почему прочность закрепления собирателя в различных точках этой поверхности неодинакова. Опыты подтверждают [164], что на ряде минералов (например, на сфалерите и халькопирите) водой отмывается лишь часть закрепившегося ксантогената. Другая часть реагента (да и то не полностью) может быть снята только спе циально подобранными реактивами.
Из рассмотренного выше следует, что энергия связи катиона ми нерала с анионом собирателя остается постоянной в гомологическом
87
ряду собирателей с одинаковой солидофильной группой, т. е. прак тически не изменяется при увеличении длины углеводородной группы — радикала. Но прочность закрепления собирателя опре деляется не только энергией связи его аниона с катионом решетки минерала, она зависит от природы аниона решетки, а также от длины углеводородного радикала в молекуле реагента.
С к о р о с т ь в з а и м о д е й с т в и я и п л о т н о с т ь |
с л о я |
||
с о б и р а т е л я |
н а п о в е р х н о с т и |
м и н е р а л а |
|
и и х в л и я н и е н а р е з у л ь т а т ы |
ф л о т а ц и и |
||
Под плотностью слоя собирателя имеют в виду частное от деле ния количества адсорбированного реагента на площадь поверхности минерала, подвергающейся его воздействию. При этом результаты сравнивают обычно с тем случаем, когда вся поверхность минерала покрыта сплошным мономолекулярным слоем собирателя, т. е. когда плотность адсорбционного слоя составляет 100% .
Физико-химическими исследованиями установлено, что при хи мическом закреплении собирателя плотность слоя обычно соста вляет 20—30% (из расчета на полный условный мономолекулярный слой), что обусловлено неоднородностью поверхности минералов, участки которой неодинаково активны и благоприятны для закре пления молекул (ионов) собирателя (см. рис. 12 и 13).
Опыты показывают, что для флотации достаточно иметь мономоле кулярное покрытие и притом далеко не всей поверхности минерала.
Так, А. М. Годэн и Шуман определили, что флотация халькозина с амиловым ксантогенатом становится возможной, если плотность покрытия составляет 14—15% поверхности.
А. М. Годэн сообщает, что при покрытии додециламином и лауриновой кислотой кварца и других окисленных минералов лишь на 5% мономолекулярного слоя обеспечивается высокое флотационное извлечение. -Столь низкая плотность слоя позволяет считать, что часть катионного реагента закрепляется неустойчиво на внешней обкладке двойного электрического слоя и отмывается водой.
Если плотность покрытия собирателем невелика, то увеличение ее приводит к повышению флотируемости. Это наблюдается при так называемом «голодном» расходе собирателя. Однако очень быстро, по достижении оптимальной плотности адсорбционного покрытия дальнейшее возрастание ее уже не улучшает извлечения флотацией.
Взаимодействие минералов |
с жидкой фазой пульпы приводит |
к закреплению на поверхности |
минералов новых ионов. |
При большой химической активности закрепившихся на минерале ионов по отношению к коллектору следует ожидать увеличения плотности адсорбционного слоя по сравнению с тем случаем, когда поверхность минерала не изменена.
Опыты показывают возможность образования на поверхности минерала двойного или еще более плотного адсорбционного слоя собирателя. На сульфидных минералах такие многослойные (обычно
88
до 5 слоев и более) образования с участием ксантогената изучены при помощи микрорадиографии и радиометрии. С. И. Полькин показал, что олеат натрия способен образовывать на поверхности ряда окис ленных минералов многослойные адсорбционные покрытия. Все это указывает на переход хемосорбции в гетерогенную химическую реак цию, причем первый слой является ориентированным с обращением углеводородных цепей собирателя в воду.
Считают, что образование второго слоя на поверхности минерала может начаться и до завершения образования сплошного первого слоя, так как предполагается, что в отдельных случаях хемоадсорбционное закрепление реагента на оставшихся незанятыми и малоак тивных в адсорбционном отношении участках поверхности минерала может оказаться в энергетическом отношении менее выгодным, чем формирование на других участках (уже занятых первым слоем) многослойного покрытия. Что касается структуры многослойных по крытий, то она еще не вполне выяснена.
Скорость взаимодействия минералов с собирателями опреде ляется природой, составом и состоянием поверхности минерала, также химическими и структурными, особенностями реагента и его концентрацией.
Неионогенные реагенты, труднорастворимые и эмульгируемые в воде, взаимодействуют с минералами в виде капелек (а не в виде отдельных молекул), а потому довольно медленно. Для того чтобы обеспечить достаточное для флотации воздействие таких реагентов на поверхность минералов, необходимо несколько минут или более. Взаимодействие ионогенных собирателей в обычных условиях завер шается быстрее (1—3 мин). На активных в хемосорбционном отно шении участках поверхности минерала собиратель закрепляется весьма быстро (почти мгновенно), однако по мере того, как взаимодей ствие его с ними заканчивается, скорость закрепления начинает понижаться.
О скорости взаимодействия можно судить по времени, которое необходимо для образования равновесного краевого угла. Зидлером установлено, что при концентрации ксантогената 25 мг/л (или 100 г/т) равновесное значение краевого угла достигается за 2—3 мин. Чем длиннее углеводородный радикал у ксантогената, тем больше требо валось времени для достижения равновесного значения краевого угла. Так, наиболее быстро это значение достигается при эти
ловом ксантогенате. Бутиловый |
ксантогенат реагирует |
медленнее |
||
этилового, а амиловый — медленнее бутилового. |
С к о р о с т ь |
|||
в з а и м о д е й с т в и я |
у в е л и ч и в а е т с я |
п р и |
п о в ы |
|
ш е н и и к о н ц е н т р а ц и и |
р е а г е н т а в |
р а с т в о р е . |
||
У с т а н о в л е н о , |
ч т о м а к с и м а л ь н а я |
г и д р о ф о - |
||
6 и з а ц и я п о в е р х н о с т и с у л ь ф и д о в и с а м о р о д
н ы х м е т а л л о в п р и д е й с т в и и с о б и р а т е л я |
д о |
|
с т и г а е т с я т е м б ы с т р е е , ч е м в ы ш е |
а д с о р б ц и о н |
|
н а я и х и м и ч е с к а я а к т и в н о с т ь |
д а н н о г о |
м и |
н е р а л а п о о т н о ш е н и ю к к и с л о р о д у [161].
89
Наблюдая за скоростью перехода минеральных частиц в пенный продукт, можно косвенно судить о скорости взаимодействия этих частиц с собирателем. Если минерал практически не флотирует без собирателя, то начало флотации спустя известное время после его введения свидетельствует о том, что в результате взаимодействия минерала с собирателем уже успел образоваться адсорбционный слой реагента, плотность которого обеспечивает флотацию некоторых ча стиц минерала данной крупности. Наши опыты показали, что при взаимодействии сравнительно малоокисленного галенита крупностью
—100 |
+ |
74 мк с этилксантогенатом (при расходе |
последнего |
5— |
|
7 г/т) |
за |
1 с успевает прореагировать с |
реагентом |
около 5% |
всех |
присутствующих в пульпе частиц, а через |
20 с после начала взаимо |
||||
действия |
гидрофобизуется и флотирует уже около 4 0 % частиц |
ми |
|||
нерала. |
|
|
|
|
|
Кинетика взаимодействия реагентов-собирателей с частицами минералов может быть оценена по изменению времени прилипания их к воздушному пузырьку по мере гидрофобизации поверхности этих частиц [50]. При малоокисленном галените формирование ад сорбционного слоя, плотность которого обеспечивает флотационное время прилипания (0,005 с), для бутилового ксантогената и олеата натрия при концентрациях, отвечающих расходу в 20 г/т, в основном завершается через 60—80 с после начала взаимодействия. Особенно
быстро |
процесс взаимодействия |
протекает в |
первые 30 с, при |
чем бутиловый ксантогенат реагирует заметно |
быстрее, чем олеат |
||
натрия. |
|
|
|
По мере окисления галенита скорость его взаимодействия с бути |
|||
ловым |
ксантогенатом и олеатом |
натрия снижается, но бутиловый |
|
ксантогенат все же реагирует быстрее олеата натрия. Понятно, что для различных минералов эта скорость неодинакова.
Вопрос о скорости взаимодействия реагентов-собирателей с ми нералами и плотности формирующегося при этом адсорбционного слоя, определяющих степень гидрофобизации минерала, имеет непо средственный практический интерес. Действительно, флотация той или иной частицы минерала не может начаться раньше того момента времени, когда закончится формирование адсорбционного слоя со бирателя, имеющего плотность, обеспечивающую флотацию этой частицы. Как установлено в ряде исследований, чем крупнее частица минерала, тем при большей плотности адсорбционного слоя собира теля данная частица начинает флотироваться. В соответствии с этим время, необходимое для формирования слоя указанной плотности, зависит от концентрации собирателя, а также от природы собирателя и минерала и для частиц разной крупности будет различным. Для обеспечения эффективной флотации как крупных, так и мелких частиц, условия воздействия на них реагента должны быть различ ными. Крупные частицы, взаимодействующие с реагентом медлен нее и требующие большего времени для создания на их поверхности адсорбционного слоя нужной плотности по сравнению с мелкими частицами, нуждаются к контакте с реагентом при его относительно
90
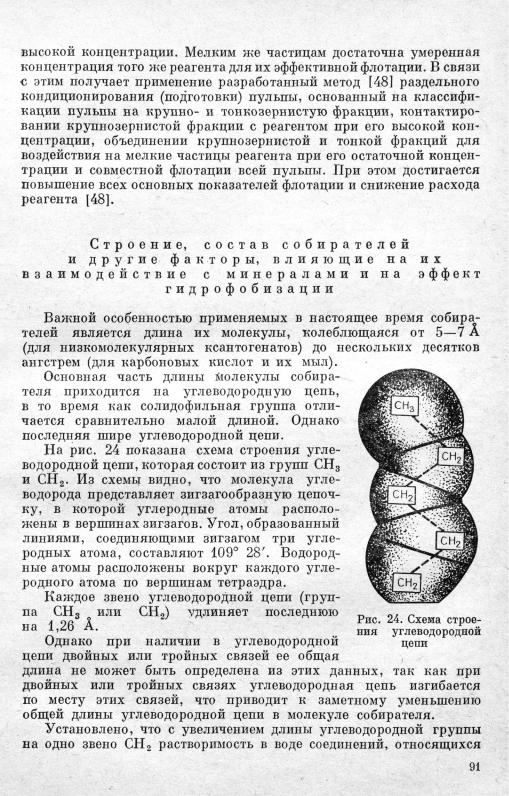
к одному и тому же гомологическому ряду, уменьшается в среднем в 4,25 раза, что главным образом связано с повышением взаимодей ствия углеводородных цепей при увеличении их длины.
Этот вопрос подробно рассмотрен в работе И. А. Каковского [14], где показано, что между углеводородными цепями реагента-собира теля в адсорбционных слоях возникает дисперсионное взаимодей ствие (притяжение), энергия которого возрастает с увеличением длины углеводородных цепей собирателя.
Расчеты показывают, что наиболее активно взаимодействуют угле водородные цепи нормального строения и с разветвлением цепей энергия дисперсионного взаи
|
|
модействия |
снижается. |
Эти |
||||||||
|
|
соображения |
высказываются |
|||||||||
|
|
также |
в |
работе |
X . |
Шубер |
||||||
|
|
та |
[245]. |
|
|
|
|
|
|
|
||
|
|
На |
рис. |
|
25 показаны |
|||||||
|
|
в силовом изображении энер |
||||||||||
|
|
гия |
|
химического |
взаимо |
|||||||
|
|
действия |
1 |
(между |
катио |
|||||||
|
|
нами |
решетки |
|
минерала |
и |
||||||
|
|
полярными |
группами |
соби |
||||||||
|
|
рателя), |
а |
также |
энергия |
|||||||
|
|
дисперсионного |
взаимодей |
|||||||||
|
|
ствия 2 (между |
углеводород |
|||||||||
Рис. 25. Энергия химического взаимодей |
ными |
цепями |
|
собирателя). |
||||||||
ствия катионов кристаллической |
решетки |
Как |
видно |
из |
схемы, |
иону, |
||||||
минерала с полярными группами |
собира |
вытесняющему |
|
собиратель |
||||||||
теля 1 и дисперсионного взаимодействия |
|
|||||||||||
с поверхности |
минерала, |
не |
||||||||||
углеводородных* цепей собирателя |
2 в си- |
|||||||||||
ловом изображении (по И. А. Каковскому) |
обходимо |
|
преодолеть |
|
не |
|||||||
|
|
только |
энергию |
химической |
||||||||
связи аниона собирателя с катионом минерала, но и межмолекуляр ные (дисперсионные) силы сцепления, действующие между углево дородными цепями собирателя. Таким образом, хотя энергия связи аниона собирателя с кристаллической решеткой минерала зависит только от природы последнего и от состава и структуры солидофиль ной группы собирателя и не зависит от углеводородной цепи реа гента, общая устойчивость адсорбционного слоя собирателя опре деляется также и с учетом дисперсионного взаимодействия между углеводородными цепями, возрастающего с увеличением их длины.
Так как энергия связи солидофильной группы собирателя с кри сталлической решеткой минерала практически не изменяется при увеличении длины углеводородной цепи реагента, то эффективность гидрофобизующего действия собирателей гомологов (с одинаковой солидофильной группой) зависит только от свойств и особенностей углеводородных цепей этих реагентов.
Чем длиннее углеводородная цепь собирателя, тем устойчивее по отношению к воде адсорбционный слой собирателя на поверх ности минерала ввиду возрастания дисперсионного притяжения этих
92
цепей в слое. Чем в большей степени и на большее расстояние от этой поверхности разрушаются гидратные слои вокруг минеральной частицы, тем значительнее она гидрофобизуется данным собирателем. Вместе с тем влияние растворимости собирателя и дисперсионного взаимодействия его молекул на гидрофобизующий эффект нельзя переоценивать. Нам уже известно, что плотность адсорбционного слоя на поверхности минерала для типичных случаев флотации не велика, а распределение реагента на поверхности неравномерно ввиду неоднородности последней. Поэтому не все молекулы (ионы) собирателя расположены на поверхности минерала столь близко друг от друга, чтобы силы Ван-дер-Ваальса (быстро убывающие с расстоянием) проявлялись в достаточной степени.
Однако с увеличением длины углеводородной цепи собирателя энергия его связи с минералом не изменяется, а свободная энергия поверхности возрастает. Поэтому, энергетические условия закрепле ния собирателя на минерале с увеличением длины углеводородной цепи реагента становятся все менее и менее благоприятными. Кроме того, использованию собирателей с очень длинными углеводород ными цепями препятствует их малая растворимость в воде, обусло вленная значительной энергией дисперсионного взаимодействия угле
водородных групп между собой. При малой |
растворимости будут |
|
возникать |
затруднения в равномерном распределении собирателей |
|
по всему |
объему пульпы, без чего не может быть достигнута высокая |
|
эффективность собирательного действия при |
умеренном расходе |
|
и приемлемых экономических показателях. Нельзя не учитывать также и того, что с удлинением углеводородной цепи собирателя вызываемая им гидрофобизация столь значительна, что даже при небольших расходах реагента стираются различия между отдель ными минералами и заметно понижается селективность (избиратель ность) действия реагента. Высокая стоимость, которой отличается
большинство собирателей с длинной углеводородной цепью, |
также |
||||||
ограничивает их |
применение. |
|
|
|
|
||
В табл. 6 приводятся значения краевых углов смачивания для |
|||||||
различных ксантогенатов, |
отличающихся длиной углеводородной |
||||||
цепи (по А. Ф. Таггарту). |
|
|
|
|
|
||
Как видно, |
э ф ф е к т |
г и д р о ф о б и з а ц и и , |
х а р а к |
||||
т е р и з у е м ы й |
в е л и ч и н о й к р а е в о г о |
у г л а , |
н е |
||||
п р е р ы в н о в о з р а с т а е т с у д л и н е н и е м |
у г л е в о |
||||||
д о р о д н о й ц е п и |
к с а н т о г е н а т а . |
Аналогичная |
кар |
||||
тина наблюдается и |
для |
собирателей с другими |
солидофильными |
||||
группами. |
|
|
|
|
|
|
|
Из приведенных данных следует, что для низших гомологов, |
|||||||
удлинение углеводородной цепи на одну группу С Н 2 |
приводит к более |
||||||
резкому усилению эффекта гидрофобизации, чем для гомологов,, отличающихся сравнительно длинными углеводородными радика лами. Так, например, при переходе от метилксантогената к этилксантогенату краевой угол возрастает на 10°, а увеличение краевого угла на 10° (от 86 до 96°) при переходе от изоамилового к цетиловому
|
|
|
|
|
Т а б л и ц а 6 |
|
Краевые углы смачивания |
для различных ксантогенатов |
|||
|
|
Достигаемая |
|
Формула |
Достигаемая |
Радикал |
Формула |
величина |
Радикал |
величина |
|
радикала |
краевого |
радикала |
краевого |
||
|
|
угла, град |
|
|
угла, град |
Метил |
СН3 |
50 |
Цетил |
СН3 (СН2 )1 б |
96 |
Этил |
с н 3 - с н 2 |
60 |
Бензил |
С6 Нб'СН2 |
72 |
в-Пропил |
СН3 (СН2 )2 |
68 |
Цикло- |
СвНц |
75 |
к-Бутил |
СН3 (СН2 )3 |
74 |
гексил |
|
|
|
|
|
|||
Изобутил |
СН3 (СН2 )3 |
78 . |
|
|
|
Изоамил |
СН3 (СН2 )4 |
86 |
|
|
|
ксантогенату достигается в результате увеличения длины углеводо родной цепи на 11 (!) групп.
Из рис. 26 видно снижение необходимого для полной флотации расхода ксантогенатов с увеличением длины их углеводородной цепи.
Это иллюстрирует на при
^ 4 -< ц— |
|
|
|
|
|
мере |
ксантогенатов |
повы |
|||||||
С |
|
|
|
|
|
|
шение эффективности фло |
||||||||
|
|
|
|
|
|
|
тационного |
действия |
со |
||||||
<3 |
|
|
|
|
|
|
бирателей |
с |
удлинением |
||||||
|
|
|
|
|
|
|
их |
углеводородных |
|
(апо- |
|||||
I |
|
|
|
|
|
|
лярных) |
групп. |
Важно, |
||||||
|
|
|
|
|
|
однако, |
отметить, |
что |
чем |
||||||
«а |
|
|
|
|
|
|
длиннее |
|
углеводородная |
||||||
|
|
|
|
|
|
цепь |
собирателя, |
|
тем в |
||||||
|
Nq2 |
|
|
|
|
|
|
||||||||
«а |
|
|
|
|
|
меньшей степени |
ее |
даль |
|||||||
|
|
|
3 |
|
|
||||||||||
|
|
|
4 |
5 |
нейшее |
удлинение |
|
приво |
|||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
с |
|
|||||||||
|
|
|
|
|
|
дит |
к повышению |
эффек |
|||||||
? |
S |
9 |
|
10 |
11 |
„12 |
|||||||||
|
Длина аниона |
ксантогената, |
А |
тивности действия |
реаген |
||||||||||
Рис. 26. Влияние длины аниона ксантоге |
та. |
|
Эта |
закономерность |
|||||||||||
может быть связана с тем, |
|||||||||||||||
ната на его расход, |
обеспечивающий извле |
что |
|
гидрофобизационный |
|||||||||||
|
чение |
80% |
галенита |
|
|
||||||||||
|
|
|
|
|
|
|
эффект |
от |
|
закрепления |
|||||
|
|
|
|
|
|
|
на |
минерале |
ионов |
соби |
|||||
рателя |
должен |
быть |
тем |
выше, чем на |
более |
близком |
расстоянии |
||||||||
от поверхности минерала происходит разрушение ориентированных гидратных слоев внедрением в них аполярных групп реагента.
Приведенные данные свидетельствуют о нецелесообразности при менения собирателей, которые отличаются очень длинными угле водородными цепями. Из этих данных также видно, что замена короткоцепных собирателей, например, этилового или пропилового ксан тогената бутиловым и амиловым выгодна, так как обеспечивает рез кое усиление гидрофобизации. Не следует, однако, считать это поло жение применимым для всех случаев. На практике иногда (например,
94
для повышения селективности действия) этиловый ксантогенат пред почитают бутиловому и амиловому.
Р а з в е т в л е н и е у г л е в о д о р о д н о й ц е п и |
с о б и |
||||
р а т е л я ( п е р е х о д о т н о р м а л ь н о г о |
с т р о е н и я |
||||
р а д и к а л а |
к и з о с т р о е н и ю ) с к а з ы в а е т с я , |
к а к |
|||
п р а в и л о , |
о т р и ц а т е л ь н о |
н а |
с о б и р а т е л ь н о м |
||
д е й с т в и и |
р е а г е н т а , так как оно сопровождается уменьше |
||||
нием дисперсионного взаимодействия и увеличивает растворимость как самого реагента, так и его производных (при одном и том же числе углеродных атомов углеводородная цепь изостроения короче нормальной).
Для собирательного действия реагента имеет значение также принадлежность его углеводородного радикала к жирному или арома тическому ряду (открытая углеводородная цепь или циклическая).
Эффект гидрофобизации, вызываемый собирателем с одной цикли ческой группировкой в углеводородной цепи (шесть атомов углерода), приблизительно одинаков с эффектом действия собирателя, имеющего этиловый радикал.
Собиратели с циклической аполярной группой не обладают ка кими-либо особыми преимуществами по сравнению с собирателями, имеющими в качестве аполярной группы углеводородные цепи от крытого строения, и потому не получили широкого распространения в промышленности.
Солидофильная группа собирателей может иметь кислый или основной характер. Собиратели, имеющие солидофильные группы кислого характера, можно подразделить на карбоксильные и сульфгидрильные. Типичными собирателями с карбоксильной группой являются мыла и карбоновые кислоты. К собирателям сульфгидрильного типа относятся ксантогенаты, меркаптаны, дитиофосфаты и др_
Изменения в составе и структуре солидофильной группы обусло вливают различия в собирательном действии этих реагентов на ми нералы.
Введение заместителей в химически активную солидофильную группу приводит к изменению энергии химической связи аниона собирателя с катионом кристаллической решетки и тем самым влияет на собирательную силу реагента. Показательно изменение собирательной способности аналогов ксантогената при переходе от ыонотиокарбоната к дитиокарбонату (ксантогенату) и от него к тритиокарбонату.
На схеме представлены структурные формулы этих трех реагентов:
|
I I I . |
R - S - O |
|
||
|
|
а |
6 |
I |
в |
|
|
|
|
|
|
где I — монотиокарбонат; I I — дитиокарбонат; |
|
I I I |
— тритиокар- |
||
бонат; при этом а — углеводородный радикал; |
б — солидофильная |
||||
группа; |
в — связь солидофильной группы с |
катионом |
кристалли |
||
ческой |
решетки минерала. |
|
|
|
|
95
