
- •Г. Б. Смирнов Механизмы приобретения и потери генетической информации бактериальными геномами гу нии эпидемиологии и микробиологии им. Н.Ф. Гамалеи рамн, 123098 Москва, ул. Гамалеи, 18.
- •(Успехи современной биологии, 2007)
- •I. Потеря и приобретение генетического материала.
- •I.1. Примеры редукции геномов.
- •I.2. Общепринятое объяснение редукции геномов.
- •I.3. Факты, которые трудно объяснить с помощью общепринятой концепции.
- •II. Молекулярные механизмы потери и приобретения генетического материала
- •II.1. Нуклеотидные последовательности в точках рекомбинации при интеграциях и делециях.
- •II.2. Сайты интеграции (tРнк, интегроны, is-элементы, короткие повторы).
- •II.3. Распределение is-элементов и повторяющихся последовательностей в геномах.
- •II.4. Образование повторов.
- •II.5. Молекулярные события, приводящие к геномным перестройкам.
- •III. Полинуклеотидный (Пн) выбор
- •III.1. Вклад Пн-выбора и фенотипического отбора в приобретение и потерю фенотипически значимых генов.
- •IV. Выбор пути эволюции генома. Гипотеза пульсации генома.
- •V. Заключение
- •Литература
IV. Выбор пути эволюции генома. Гипотеза пульсации генома.
В свете представлений о Пн-выборе редукция геномов может рассматриваться следующим образом. Геномы, структура которых благоприятствует утрате генетического материала, подвергаются редукции и постепенно утрачивают степени свободы своего (своих носителей) существования. Например, у Buchnera aphidicola на определённом этапе эволюции были утрачены все гены, за исключением тех, которые позволяли этим бактериям существовать в организмах растительных тлей. Соответственно, бушнерa остались в тлях. Более того, они утратили ген recA, что ограничило возможности дальнейших перемен в их геномах только событиями незаконной рекомбинации.
Такой путь уготован далеко не всем эндосимбионтам. В частности, бактерии Wolbachia, видимо, не имели такой жесткой программы редукции, как бушнера и, будучи эндосимбионтами-паразитами, остались способными инфицировать самых разнообразных хозяев: муравьёв, жуков, плодовых мушек, пауков (в качестве паразитов) и даже нематод (в качестве симбионтов). Более того, они сохранили способность к рекомбинации и активно её используют, — их геномы участвуют в частых актах межгенных обменов и горизонтального переноса [17, 112, 113, 83].
У каждого вида бактерий существует своя собственная программа развития генома. Так, из почвенной бактерии общего предшественника образовались виды B. mallei — возбудитель сапа, B. pseudomallei — возбудитель мелиоидоза, и B. thailandensis — непатогенный сапрофит, геномы которых, сохраняя родство, существенно отличаются и по набору генов, и по направлению развития.
В том случае, когда эволюция генома идёт по пути редукции среди геномных перестроек преобладают делеции. Делеции — это события, которые могут привести не только к утрате генов. Они приводят к тем же последствиям, что и транслокации и инверсии, то есть к изменению нуклеотидных последовательностей и, следовательно, имеют такой же эволюционный потенциал. Потеря сегментов ДНК при компактизации геномов — это делетирование. Следовательно, компактизация генома, изменяя его нуклеотидные последовательности, может изменить вероятность последующих перестроек, в том числе интеграции сегментов ДНК в сайты, возникшие вследствие делетирования. При этом, нас интересуют случаи увеличения такой вероятности. Коль скоро, на месте делетируемых нуклеотидных последовательностей возникают новые нуклеотидные последовательности, то в случае формирования эффективного сайта интеграции, в этот сайт будут внедряться сегменты ДНК (блочные модули), отличающиеся от делетированных. Тогда компактизация генома сама по себе может не только создавать условия для последующей экспансии, но и обеспечивать поглощение геномом качественно новой информации. Отсюда следует, что программа генетических изменений генома изменяется в ходе осуществления этих изменений и определяется уже произошедшими генетическими перестройками.
Можно предположить, что после достижения минимального размера генома, совместимого с условиями существования, часть популяции вида, может начать новый цикл захвата генетического материала. Этому может способствовать и мутационный процесс. Показано, что редукция геномов приводит к увеличению частоты точковых замен пар оснований ДНК [67, 116, 52], что возможно, в значительной степени связано с утратой редактирующих и других компонентов репаративных систем на ранних стадиях редукции [8, 35]. Высокая частота замен должна увеличить вероятность образования сайтов интеграции вновь привнесённых фрагментов ДНК в геном.
Если такой процесс может иметь место, то пульсация геномов представляется одним из возможных механизмов эволюции.
Гипотеза пульсации геномов в общих терминах и формально противоречит так называемому «закону Долло», который утверждает, что «эволюция прерывиста, необратима и ограниченна» [39], но вполне согласуется со взглядами Соболева, краеугольным камнем теории которого является обратимость процесса эволюции [5]. В рамках концепции пульсации генома фаза редукции представляется следующим образом. В геноме произошло такое распределение горячих точек рекомбинации (IS-элементы, профаги, повторяющиеся последовательности), которое благоприятствует утрате генетического материала. Если возникающие делеции затрагивают гены, необходимые для жизни в окружающей среде, фракция популяции данного обладателя редуцирующегося генома гибнет. Выживает та фракция популяции, которая оказывается в более благоприятных условиях, в которых делетированные гены не требуются. В этих условиях процесс компактизации может продолжаться до тех пор, пока объём и содержание генома будут совместимы с жизнью его обладателя. То есть, компактизация (делеции) начинается не тогда, когда бактерии попали в организм теплокровного, а тогда, когда для компактизации создались условия в геноме. В эукариотическом организме этот процесс будет успешно продолжаться без таких потерь выживаемости, какие могут быть в иных, менее благоприятных условиях.
Совершенно очевидно, что «пульсация геномов» — механизм достаточно медленный даже по геологическим мерам времени и поэтому применимый только для эволюции геномов, скорость размножения носителей которых сравнима с таковой у бактерий.
Если редукция геномов не ведёт в тупик, то в реально существующих редуцированных геномах должны происходить изменения, отличные от редукционных, т.е. от делеций. Такие изменения удается зарегистрировать. Например, среди патогенных бактерий значительной редукции подвергся генов M. leprae. При этом установлено, что пролил-тРНК синтетаза, кодируемая геном proS, в отличие от других тРНК синтетаз, не гомологична одноимённому ферменту M.tuberculosis, а более всего близка с ферментом Borrelia burgdoferi и эукариотов (дрозофилы, человека и дрожжей) (Рис. 9). Предполагается, что M. leprae получила ген proS от B.burgdoferi, которая в свою очередь, унаследовала его от человека. Ген proS расположен в геноме M. leprae в ином месте и инвертирован по сравнению с положением proS в геноме M.tuberculosis [34] (Рис. 9). То есть редукция генома в данном случае не была препятствием для наследования гена за счёт горизонтального переноса.

Рис. 9. Позиции гена proS в хромосомах Micobacterium leprae (верх) и Micobacterium tuberculosis (низ).
Наряду с M. genitalium обладателем очень маленького бактериального генома является B. aphidicola — эндосимбионт растительных тлей. Сравнивая полные нуклеотидные последовательности геномов двух клонов B. aphidicola Bap и Bsg, выделенных из различных видов афид (Acyrthosiphon pisum и Schizaphis graminum — принадлежат подсемейству Aphidinae, но различным трибам: Macrosiphini, и Aphidini, соответственно), авторы обнаружили, что за огромный срок (десятки миллионов лет) в геномах не произошло никаких изменений: транспозиций, дупликаций или приобретений извне, — найдено лишь несколько потерь. Это состояние бушнера было названо геномным застоем [100].
С учётом данных, полученных с другими штаммами бушнера картину процесса, названного «50-ти миллионолетним геномным застоем» [100] можно кратко суммировать следующим образом. Предшественник B. aphidicola содержал криптическую плазмиду IncFII группы несовместимости c геном repA (Рис. 10). В его хромосоме находился лейциновый оперон. До или после установления симбиотических отношений с афидами лейциновый оперон претерпел транслокацию в плазмидный геном. Образовались лейциновые плазмиды, порядок и количество генов в которых со временем менялись и оказались различными в плазмидах разных штаммов. После этого, вероятно, происходила обратная транслокация лейциновых генов из плазмид в хромосомы некоторых штаммов. Различная локализация leu-генов в хромосомах разных штаммов B. aphidicola связана либо с геномными перестройками хромосом, либо с событиями обратной транслокации из плазмид. Более вероятно, что транслокация в криптическую плазмиду произошла ещё в общем предшественнике бушнера, а затем, возможно, уже после дивергенции афид и, следовательно, после установления симбиотических отношений с бушнера, то есть в ходе их совместной эволюции имели место события обратной транслокации генов в хромосомные сайты.

Рис. 10. Интеграция и эксцизия плазмид Buchnera aphidicola.
При этом, по меньшей мере в одном из случаев (Buchnera sp. штамм PSY) установлено, что рекомбинация при реинтеграции в хромосому плазмиды, содержащей гены лейцинового оперона, произошла между двумя прямыми повторяющимися последовательностями, одна из которых находится между хромосомными генами rep и trxA, а другая — между плазмидными генами leuD и leuA [94].
Каким-то образом ген ibp сначала попал в две из семи известных плазмид бушнера, а затем он переместился в хромосомы двух (из трёх сиквенированных) геномов бушнера, а в одном из штаммов в сайте его интеграции оказались гены триптофанового оперона. В некоторых штаммах бушнера образовались химерные pTrp/Leu плазмиды, а в некоторых плазмидах к гену repA добавился repA/C [46, 107] (Рис.11).
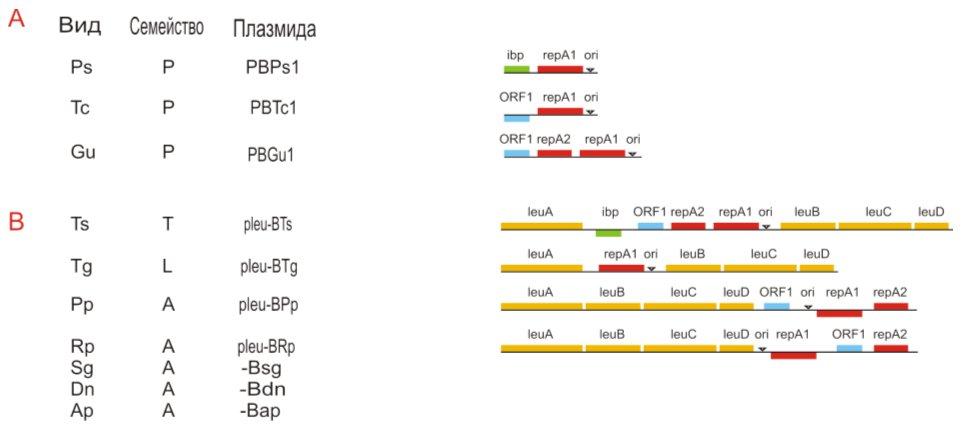
Рис. 11. Структура плазмид Buchnera aphidicola.
Перечисленные различия в локализации одних и тех же генов как в хромосомах, так и в плазмидах Buchnera sp могли возникнуть и в досимбиотический, и в постсимбиотический периоды эволюции эндосимбионтов. Однако вряд ли различия (если они существуют) в биохимии организмов тлей, принадлежащих разным семействам, могли определить различную локализацию генов в плазмидах и хромосомах бактерий бушнера. В пользу этого говорит также следующее наблюдение.
Эндосимбионт мухи це-це W. glossinidia и эндосимбионт тлей B. aphidicola призошли от общего с E.coli предшественника. Однако плазмида W. glossinidia pWig1 отличается от плазмид B. aphidicola. Она содержит 6 не родственных генов. Если бы все эти гены были метаболическими, то их присутствие в плазмиде можно было бы объяснить особенностями отбора со стороны хозяина (мухи це-це), а отличия от плазмид бушнер — биохимическими отличиями мухи це-це от растительных тлей. Однако в плазмиде pWig1найдены гены, кодирующие белок теплового шока (WGpWb0006 [ http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=Retrieve&dopt=full_report&list_uids=3112730 ]), (его кодирует ортолог гена ibp B. aphidicola BAp и B. aphidicola BSg), липопротеин TraT (устойчивость к нормальной сыворотке и поверхностное исключение WGpWb0003 [http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=Retrieve&dopt=full_report&list_uids=3112725]), белок-механосенсор (ген yggB [ http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=Retrieve&dopt=full_report&list_uids=3112727 ]) и неизвестный гипотетический белок (WGpWb0004 [ http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=Retrieve&dopt=full_report&list_uids=3112726 ]) [8]. Видимо, различия генов плазмид у W. glossinidia и B. aphidicola имеют иные причины, нежели различные метаболические потребности мух. Скорее всего, перечисленные гены плазмиды pWig1 сохранились от общего предшественника и не были делетированы, несмотря на невостребованность их продуктов в условиях облигатного эндосимбиотизма.
Поскольку в ряде случаев зарегистрированы генетические различия у бактерий (Buchnera sp. BBp и BPs), живущих в одном и том же подсемействе тлей [95], очевидно то, что после установления симбиотизма происходили не только редуктивные изменения геномов бушнера, но и разнообразные обмены между хромосомой и плазмидой.
В чём причина транслокации генов лейцинового и триптофанового оперонов у предшественника B. aphidicola из хромосомы в плазмиды неизвестно. Сначала предполагалось, что эти события обусловлены селекцией признака суперпродукции лейцина и триптофана, необходимых для жизни афид. Однако оказалось, что хромосома B. aphidicola тоже мультикопийна [57]. Репликаторы плазмид бушнер относятся к классу несовместимости IncFII, и копийность плазмид может быть даже ниже, чем копийность хромосомы [81], что делает предположение о преимуществах плазмидной локализации генов биосинтеза лейцина и триптофана бессмысленным. То есть объяснение закрепления генов в плазмидах за счёт фенотипического отбора некорректно. С точки зрения фенотипического отбора непонятны также, причины обратной транслокации этих генов в хромосомы. Тем более, влиянием фенотипического отбора никак нельзя обьяснить различную хромосомную локализацию генов лейцинового оперона (4 разных сайта внедрения) в хромосомах различных штаммов B. aphidicola. Однако перечисленные факты свидетельствуют о рекомбинационных событиях, отличных от делеций и происходивших в максимально редуцированных геномах.
В дополнение к этим данным, получено одно очень важное свидетельство горизонтального постсимбиотического переноса генетического материала у B. aphidicola [108]. Было установлено, что ген repA1 из плазмиды pBPs1 B.aphidicola, выделенной из тлей Pemphigus spyrothecae, существенно отличается от всех известных repA1 последовательностей бушнера. На основе филогенетического анализа был сделан вывод о том, что ген repA1 попал в плазмиду за счёт горизонтального переноса. Поскольку этот вывод чрезвычайно важен и относится к единственному достоверному случаю постсимбиотического приобретения генетического материала бушнерами, авторы приводят определённые доказательства помимо традиционного филогенетического анализа. Так, плазмида pBPs1, в которой находится уникальный ген repA1, содержит ген ibp, происходящий из хромосомы и полностью филогенетически соответствующий Buchnera. Таким образом, плазмида pBPs1 является рекомбинантной и содержащей ген ibp хромосомного происхождения и горизонтально перенесённый ген repA1 неизвестного происхождения. У B. aphidicola, выделенной из P. spyrothecae, найдены триптофановые плазмиды, которые по свойствам репликона несколько отличаются от других плазмид B. aphidicola [107], но гены trp оперона, как и ген ibp плазмиды pBPs1, происходят из хромосомы Buchnera.
Источник гена repA1 B.aphidicola, выделенной из P. spyrothecae, остаётся неизвестным, но им могли быть вторичные эндосимбионты или свободноживущие бактерии. Итак, в организме, геном которого находится почти в низшей точке редукции, могут происходить как генетические перестройки, так и приобретение генов извне.
Коль скоро, ген recA в сиквенированных геномах B. aphidicola делетирован, объём рекомбинационных событий в этих геномах ограничен возможностями recA-независимой рекомбинации. То есть мы располагаем свидетельствами рекомбинационной активности генома B. aphidicola, количество которых занижено в результате потери гена recA. Это означает, что в рекомбинационно профицитных редуцированных геномах приобретение генетического материала тем более может иметь место. Последнее подтверждается особенностями генетического поведения бактерий Wolbachia. Эти бактерии взаимодействуют с инфицируемыми ими объектами в очень широких рамках отношений: от симбиотического мутуализма до строгого паразитизма. Геном различных изолятов бактерий Wolbachia содержит от 800 до 1200 генов, кодирующих белки, то есть на 300 — 700 генов больше, чем бактерии B. aphidicola. Будучи эндосимбионтами (паразитами), они сохранили способность к рекомбинационному обмену, включая горизонтальный перенос, и соответственно, к разнообразным геномным перестройкам [17, 112, 83].
Приведенные данные говорят о возможности дальнейших эволюционных преобразований редуцированных геномов, то есть являются веским аргументом в пользу гипотезы «пульсации» геномов.
