
КНИЖЕЧКАметод_указ_мед_химия
.pdfКОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.
АКТУАЛЬНОСТЬ ТЕМЫ.
К коллигативным свойствам растворов, т.е. свойствам, зависящим от количества частиц, относятся осмотическое давление, диффузия, понижение температуры замерзания и повышение температуры кипения растворов по сравнению с чистым растворителем. Осмотическое давление обеспечивает упругость и эластичность тканей. Коллигативные свойства физиологических, гипертонических и гипотонических растворов связаны с их клиническими свойствами. В медицинской практике используется криометрический метод определения осмотического давления по понижению температуры замерзания раствора называют депрессией. Определение депрессии крови, лимфы, мочи позволяет рассчитывать «осмотическую» концентрацию, которую невозможно определить другими методами.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь интерпретировать коллигативные свойства растворов, которые используются в медицине и биологии.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Идентифицировать явление осмоса и его биологическое значение.
2.Интерпретировать зависимость осмотического давления согласно закона Вант-Гоффа.
3.Интерпретировать явления, которые наблюдаются с живой клеткой, в растворах с различной осмотической концентрацией.
4.Рассчитывать по депрессии точки замерзания растворов осмотическое давление.
5.Рассчитывать моляльную концентрацию и молярную массу растворов.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Диффузия в растворах. Коллигативные свойства разбавленных растворов. Первый закон Рауля.
2.Осмос. Осмотическое давление. Закон Вант-Гоффа.
3.Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент.
4.Изотонический, гипертонический и гипотонический растворы и их применение в медицине.
5.Биологическое значение коллигативных свойств растворов. Гемолиз и плазмолиз.
71
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
Понятие о коллигативных свойствах растворов
Понижение температуры замерзания и повышение температуры кипения растворов.
Закон Рауля
Эбулиоскопия, криоскопия
Определение молекулярный массы и осмотического давления
Осмос. Осмотическое давление.
|
|
Закон Вант- |
|
|
|
Гипо-, гипер-, и изото- |
||
|
|
Гоффа |
|
|
|
нические растворы |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изотонический |
|
|
|
Плазмолиз, гемолиз |
|
|
|
|
коэффициент |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Определение степени |
|
|
|
Физиологический |
|||
|
|
диссоциации и |
|
|
|
раствор |
||
|
|
осмотического |
|
|
|
|
|
|
|
давления электролитов |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Значение коллигативных свойств растворов в биологии и медицине
72
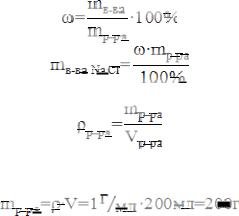
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 111-127.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 126-140.
Дополнительная литература.
3.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 49-59.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 33-44.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к практическому занятию.
РЕШЕНИЕ ОБУЧАЮЩИХ ЗАДАЧ.
Задача 1.
В медицинской практике для компенсации больших потерь крови больному вводят физиологический раствор. Определите, сколько граммов соли NaCl потребуется для приготовления 200 мл физиологического раствора (плотность раствора принять равной 1 г/мл).
Эталон решения:
Метод основан на понятии о физиологическом растворе и концентрациях растворов.
1. Что такое физиологический раствор?
Физиологический раствор должен иметь такое же осмотическое давление, как и кровь, то есть быть изотоничным крови.
В качестве такого раствора в клинической практике используется 0,9% раствор NaCl
2.Для приготовления 200 мл 0,9% раствора NaCl используем понятие о процентной концентрации, которая определяется по формуле:
3.Массу раствора определяем по формуле:
где ρ – плотность р-ра, г/мл.
В условии задачи ρр-ра = 1 г/мл, следовательно:
4. Для приготовления 200 мл физиологического раствора потребуется:
73
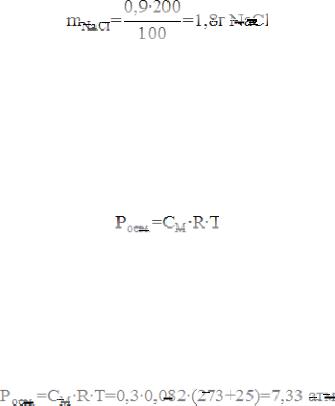
Задача 2.
Общая осмотическая концентрация в плазме крови в норме составляет 0,3 моль/л. Рассчитайте осмотическое давление плазмы крови при t° = 25°C
Эталон решения:
Метод основан на законе Вант-Гоффа.
1. Для определения осмотического давления записываем уравнение ВантГоффа:
где С – молярная концентрация, моль/л;
R – универсальная газовая постоянная, R=0,082 атм∙л∙моль-1∙К-1; Т – абсолютная температура, К.
2.Для биологических жидкостей введено понятие осмотической концентрации. Она определяется суммарной концентрацией всех частиц в жидкости и используется для расчета Росм вместо молярной концентрации.
3.Рассчитываем осмотическое давление крови при 25° С
4.Осмотическое давление крови при 25° С ниже нормы (норма 7,7 атм)
Задача 3.
Осмотическое давление плазмы крови в среднем равно 7,7 атм. Рассчитайте депрессию температуры замерзания крови при t° = 37°C
Задача 4.
Рассчитать молярную концентрацию раствора глюкозы для внутривенного введения. Осмотическое давление крови 7,7 атм.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Перемещение веществ в клетку осуществляется при помощи осмоса. Укажите, наличие каких двух факторов является причиной возникновения осмоса:
A.Несмешивающиеся жидкости, разделенные ППМ;
B.Растворы с одинаковой концентрацией, разделенные ППМ;
C.Растворы с разной молярной концентрацией, разделенные ППМ;
D.Растворы с разными несмешивающимися растворителями;
E.Растворы, разделенные стеклянной перегородкой.
74
Задание 2.
Явление гемолиза наблюдается в растворах определенной концентрации. Укажите процентное содержание раствора NaCl, в котором будет наблюдаться гемолиз.
A.12
B.10
C.5
D.0,9
E.0,1
Задание 3.
Для расчета осмотического давления растворов электролитов вводится изотонический коэффициент i. Укажите фактора, который определяет величину данного коэффициента.
A.Молекулярная масса вещества;
B.Температура замерзания раствора;
C.Природа растворителя;
D.Степень диссоциации растворенного вещества;
E.Осмотическое давление.
Задание 4.
Вычислите осмотическое давление Концентрация раствора NaCl равна 0,1 моль/л при t° = 25°C (R = 0,082). Вычислите осмотическое давление данного раствора.
A.11,52;
B.6,73;
C.4,89;
D.1,29;
E.1,24.
Задание 5.
Осмотическое давление одна из важнейших характеристик водных растворов. Укажите раствор с наибольшим осмотическим давлением.
A.0,1М глюкозы;
B.0,1М уксусной кислоты;
C.0,1М хлорида кальция;
D.0,1М хлорида натрия;
E.0,1М белка.
Задание 6.
Раствор NaCl является изотоничным крови (Росм крови = 7,7 атм; R = 0,082). Укажите его молярную концентрацию.
A.0,41;
B.0,32;
C.0,25;
75
D.0,23;
E.0,15.
Задание 7.
Гипертонические растворы солей MgSO4 и Nа2SO4 применяются в качестве слабительных средств. Укажите, какое уравнение можно использовать для расчета осмотического давления в растворе Nа2SO4.
A.P = CRT;
B.P = 2CRT;
C.P = 3CRT;
D.P = 4CRT;
E.P = 5CRT.
Задание 8.
Температура кипения раствора описывается следствием из закона Рауля. Укажите, как изменяется tкип физиологического раствора (0,9% раствора NaCl), если увеличить концентрацию соли в нем.
A.Вначале повысится;
B.Понизится, а потом понизится;
C.Повысится;
D.Не изменится;
E.Повыситься или понизиться в зависимости от природы растворителя.
Эталоны ответов.
1 |
– C; |
5 |
– C; |
2 |
– E; |
6 |
– E; |
3 |
– D; |
7 |
– C; |
4 |
– C; |
8 – C. |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
Вначале занятия осуществляется проверка уровня подготовки студентов к занятию путем фронтальной беседы.
После этого студенты решают ситуационные задачи по теме «Коллигативные свойства растворов». В процессе решения задач разбирается теоретический материал. Обращается особое внимание на медикобиологическое значение явления осмоса и применение растворов с различной осмотической концентрацией в клинической практике.
Следующим этапом является проведение тестового контроля знаний по теме «Коллигативные свойства растворов» с использованием тестов формата А. Занятие заканчивается подведением итогов и объявлением результатов тестового контроля.
76
ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Осмос имеет большое значение для растительных и животных организмов, способствуя оводнению клеток и межклеточных структур. Осмотическое давление обуславливает тургор клеток. Осмотическое давление плазмы крови человека характеризуется постоянством и равно 7,7 атм.
Для возмещения больших потерь крови и при сильном обезвоживании внутривенно вводят физиологические растворы, изотоничные крови. Гипертоничные растворы применяются для обработки ран, при аллергических реакциях. В организме осмотическое давление является важным фактором, определяющим распределение воды и питательных веществ между органами и тканями.
В медицинской практике используется криометрический метод определения осмотического давления по понижению температуры замерзания растворов.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь определять осмотическое давление растворов по депрессии температуры замерзания, а также рассчитывать осмотическую концентрацию растворов и молекулярную массу вещества.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Определять депрессию температуры замерзания растворов.
2.Рассчитывать молярную, моляльную и массовую долю раствора.
3.Определять осмотическое давление растворов с помощью депрессии температуры замерзания этого раствора.
4.Рассчитывать молекулярную массу растворенного вещества.
5.Интерпретировать значение осмотического давления в биологии и медицине.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Осмос. Осмотическое давление в растворах электролитов и неэлектролитов.
2.Осмотическое давление плазмы крови. Онкотическое давление.
3.Второй закон Рауля. Зависимость температуры замерзания и кипения от концентрации растворов и природы растворителя.
4.Криометрия и эбулиометрия и их использование в медикобиологических исследованиях.
5.Биологическая роль осмоса и осмотического давления в биологических системах.
77
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Закон Вант - Гоффа
Закон Рауля
Криометрическое определение осмотического давления
Определение моляльной концентрации и молекулярной массы.
Гипо-, гипер- и изотонические растворы
Гемолиз, плазмолиз
Физиологический раствор
Расчет % концентрации физиологического раствора
Значение осмоса и криометрических методов исследования в биологии и медицине
78
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 111-127.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 126-141, 331-335.
Дополнительная литература.
3.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 49-59.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 33-44.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опит №1. Определение температуры замерзания исследуемого раствора.
Принцип метода: метод основан на способности растворов замерзать при более низкой температуре по сравнению с чистым растворителем.
Материальное обеспечение: стакан с охлаждающей смесью льда с солью, химический термометр, пробирка, пипетка, исследуемый раствор электролита, дистиллированная вода.
Ход работы:
1. Готовят охлаждающую смесь в стакане, состоящую из льда с солью
NaCl.
2.Пробирку заполняют исследуемым раствором и помещают в неё термометр.
3.Погружают пробирку в охлаждающую смесь.
4.С помощью термометра исследуемый раствор в процессе охлаждения перемешивают.
5.При появлении в растворе первых кристалликов льда по шкале термометра определяют температуру замерзания раствора ( t° зам).
6.Аналогично определяют температуру замерзания чистого растворителя
–дистиллированной воды.
Опыт №2. Определение осмотического давления и молярной массы исследуемого вещества на основании полученных экспериментальных данных.
Принцип метода: метод основан на законе Рауля и законе Вант-Гоффа. Материальное обеспечение: стакан с охлаждающей смесью льда с солью,
химический термометр, пробирка, пипетка, исследуемый раствор электролита, дистиллированная вода.
Ход работы:
1. Рассчитывают понижение температуры замерзания раствора tзам:
tзам = tзам воды – t зам р-ра
79
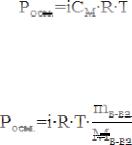
2. Определяют моляльную концентрацию (Сm) исследуемого раствора, исходя из закона Рауля:
tзам = i·Cм·Kводы,
где Kводы = 1,86;
изотонический коэффициент і = 2.
3. Осмотическое давление исследуемого раствора при комнатной температуре определяют по закону Вант=Гоффа:
для разбавленных растворов молярную концентрацию СM можно считать приблизительно равной моляльной концентрации Cm.
4. Молярную массу растворенного вещества определяют исходя из формулы:
где mв-ва – масса растворенного вещества в одном литре раствора (сообщит преподаватель), г;
– молярная масса растворенного вещества, г/моль.
5. Определите относительную ошибку измерения Mв-ва, узнав у преподавателя истинную молярную массу растворенного вещества.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Давление плазмы крови человека характеризуется достаточным постоянством и связано с движением молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией. Укажите название данного процесса.
A.Осмос;
B.Диффузия;
C.Броуновское движение;
D.Тепловое движение;
E.Химическое взаимодействие.
Задание 2.
Осмотическое давление крови человека характеризуется достаточным постоянством. Укажите пределы осмотического давления крови человека в атм.
A.1,7 – 6,7
B.4,7 – 5,7
C.7,7 – 8,1
D.8,8 – 10,8
E.10,7 – 11,7
80
