
КНИЖЕЧКАметод_указ_мед_химия
.pdfЗадание 7.
Сила галогеноводородных кислот зависит от положения кислотообразующего элемента в периодической системе. Укажите, какая из ниже приведенных кислот является наиболее сильной.
A.HF
B.HBr
C.HI
D.HCl
E.HBi
Задание 8.
Все элементы в периодической системе располагаются в больших и малых периодах. Укажите наличие какого фактора отличает их друг от друга.
A.d- и f-элементы
B.металлы
C.инертные газы
D.s-элементы
E.неметаллы
Задание 9.
К р-элементам IV группы периодической системы относятся углерод, кремний, германий, олово и свинец. Укажите, как изменяются кислотные свойства элементов в этом ряду.
A.Увеличиваются
B.Уменьшаются
C.Не изменяются
D.Сначала увеличиваются, потом уменьшаются
E.Сначала уменьшаются, потом увеличиваются
Задание 10.
Соединение меди CuSO4∙5H2O используется в фармации в качестве бактерицидного препарата. Какая формула отвечает электронной конфигурации элемента 29Cu?
A.3d104s1
B.3d94s2
C.3d64s2
D.3d84s2
E.3d74s2
Задание 11.
Для количественного определения многих лекарственных средств используют неводные растворы хлорной кислоты. Какой из приведенных оксидов соответствует этой кислоте?
A.Cl2O7
B.ClO
11
C.ClO2
D.Cl2O3
E.CI2O6
Задание 12.
Малотоксичный оксид азота под названием «веселящий газ» применяется в медицине для наркоза при хирургических операциях. Выберите это соединение.
A.NO
B.NO2
C.N2O
D.N2O3
E.N2O5
Эталоны ответов. |
|
|
|
|
|
1 |
– А; |
5 – B; |
9 – B; |
||
2 |
– A; |
6 |
– A; |
10 |
– A; |
3 |
– A; |
7 |
– C; |
11 |
– A; |
4 |
– B; |
8 |
– A; |
12 |
– C. |
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
Занятие начинается с вступительной части, которую проводит преподаватель. На занятии студенты решают обучающие задачи, в процессе этого разбирается и закрепляется теоретический материал. В ходе занятия студенты учатся, как на основании электронной формулы определить местоположение элемента в периодической системе, его основные свойства и свойства важнейших кислородных и водородных соединений, учатся составлять сравнительную характеристику свойств элементов и их соединений. Далее разбираются основные классы неорганических соединений, их сравнительные характеристики согласно их расположению в периодической системе.
Следующим этапом является проведение тестового контроля знаний студентов по теме «Периодический закон Д.И. Менделеева и основные классы неорганических соединений» с использованием тестов формата А.
Занятие заканчивается подведением итогов работы и оценкой знаний студентов: озвучиваются результаты тестового контроля.
12
БИОГЕННЫЕ S- И P- ЭЛЕМЕНТЫ, БИОЛОГИЧЕСКАЯ РОЛЬ, ПРИМЕНЕНИЕ В МЕДИЦИНЕ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Биогенные элементы – химические элементы, необходимые для построения и жизнедеятельности клеток и тканей организмов. Основу всех живых систем составляют шесть элементов-органогенов: углерод, водород, кислород, азот, фосфор, сера. Их содержание в организме достигает 97%. Физиологическая роль биогенных элементов определяется их физико-химическими свойствами, которые обусловлены положением элемента в периодической системе Д. И. Менделеева. s- и p-элементы – это элементы главных подгрупп І –VII групп периодической системы. Каждый период системы начинается двумя s- элементами, а шесть его последних элементов (кроме первого периода) – это p- элементы.
В организме человека в значительном количестве содержатся лёгкие s- и р- элементы. Так, к незаменимым макроэлементам принадлежат s-элементы первого (Н) периода, а также s-элементы третьего (Na, Mg) и четвёртого (K, Ca) периодов, которые являются биометаллами. Их ионы входят в состав буферных систем организма, обеспечивают необходимое осмотическое давление, участвуют в образовании мембранных потенциалов, в передаче нервных импульсов (Na+, K+), структурообразовании (Mg2+, Ca2+). Такие s-элементы, как бериллий, барий обладают особо токсическими свойствами.
Среди p-элементов пять элементов второго (C, N, O) и третьего (P, S) периодов являются органогенами («элементами жизни»), составляющими основу биологически важных молекул. К биогенным элементам относятся также хлор и йод, а бор, фтор, бром находятся в живых организмах в микроколичествах и являются примесными элементами. Соединения свинца и мышьяка обладают особо токсическими свойствами. Как правило, в живом организме р-элементы входят в состав сложных органических макромолекул или ионов: OH-, Cl-, SO42-, HCO3-, H2PO4-, HPO42-, F-. Они составляют основу буферной системы крови, обеспечивают необходимое осмотическое давление, содержатся в желудочном соке и других биологических средах. Многие соединения s- и p-элементов представляют собой основу для синтеза фармацевтических препаратов. Поэтому знание физико-химических свойств биогенных s- и р-элементов и их соединений необходимо для диагностики, профилактики и лечения болезней, вызванных избытком или недостатком этих элементов в организме.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь интерпретировать физико-химические свойства, биохимическую роль и медико-биологическое значение биогенных элементов IA – VIIA групп (s- и р-элементов) на основе электронного строения их атомов.
13
КОНКРЕТНЫЕ ЦЕЛИ.
УМЕТЬ:
1.Интерпретировать общую характеристику и медико-биологическое значение биогенных элементов, исходя из электронного строения их атомов.
2.Интерпретировать физико-химические свойства биогенных s- и р- элементов ІА - VIIA групп на основе электронного строения их атомов и положения в периодической системе Д. И. Менделеева.
3.Интерпретировать биохимическую роль и медико-биологическое значение биогенных s-элементов, исходя из их свойств и содержания в организме.
4.Интерпретировать биохимическую роль и медико-биологическое значение биогенных р-элементов, исходя из их свойств и содержания в организме.
5.Трактовать аналитические реакции биогенных s- и р-элементов IA – VIIA групп.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Определение и классификация биогенных элементов. Общая характеристика биогенных элементов, исходя из электронного строения их атомов, содержание в организме и биохимическая роль.
2.Общая характеристика биогенных s- и р-элементов IA – VIIA групп:
−положение в периодической системе элементов Д. И. Менделеева;
−электронная конфигурация атомов элементов;
−характерные степени окисления;
−изменение кислотно-основных и окислительно-восстановительных свойств в группах и периодах.
3.Биохимическая роль и медико-биологическое значение биогенных s- элементов (водород, литий, натрий, калий, магний, кальций).
4.Биохимическая роль и медико-биологическое значение биогенных р- элементов (углерод, азот, фосфор, кислород, сера, фтор, хлор, бром, йод, алюминий, мышьяк, бор).
5.Аналитические реакции открытия биологически активных ионов s- и р- элементов.
14
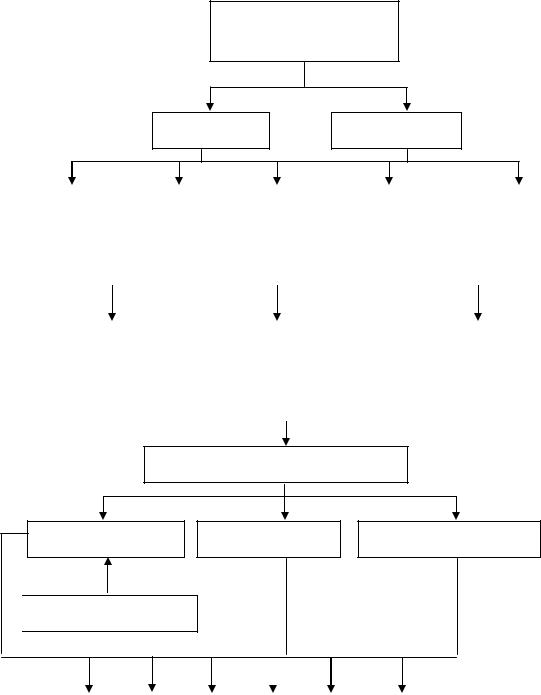
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
Биогенные элементы
IA – VIIA групп
Электронное
строение
Характеристики
элементов
s-элементы р-элементы
Атомный |
|
Степени |
|
Энергия |
|
Энергия |
|
Электроотри- |
|||||
радиус |
|
окисления |
|
ионизации |
|
сродства к |
|
цательность |
|||||
|
|
|
|
|
|
|
|
|
электрону |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Физико- |
|
|
|
|
|
|
|
|
Растворимость |
|
Кислотно-основные |
|
Окислительно- |
||||
химические |
|
|
||||||
в воде |
|
свойства |
|
восстановительные |
||||
свойства |
|
|
||||||
|
|
|
|
|
|
свойства |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Содержание в организме
Классификация
Макроэлементы Микроэлементы Ультрамикроэлементы
 Элементы-органогены
Элементы-органогены
Медикобиологическое значение
Биохимия |
|
Физиология |
|
фармакология |
|
Терапия |
|
Стоматология |
|
Гигиена |
|
|
|
|
|
|
|
|
|
|
|
15

3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 210-225, 257-282, 288-292.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 342-379.
Дополнительная литература.
3.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія.
Підручник. – Вінниця: Нова книга, 2003. – С. 272-278, 291-293, 298-299, 309,
310-311, 321-322, 340-341, 355, 363, 369, 376-377, 390-391, 408-409.
4.Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 289-541.
5.Хухрянский В.Г., Цыганенко А.Я., Павленко Н.В. Химия биогенных элементов. Киев: Вища школа, 1984. – С.12-49; 107-150.
6.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 130-135.
7.К.А. Селезнёв. Аналитическая химия. М.: «Высшая школа», 1973. –
С.72-73, 78-79, 85, 90-91, 108, 142-143, 153.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1.
Открытие иона К+ действием реактива натрия гексанитрокобальтата (III)
Na3[Co(NO2)6].
Принцип метода: метод основан на реакции взаимодействия гексанитрокобальтата (III) натрия с ионами калия в нейтральной среде с образованием желтого кристаллического осадка гексанитрокобальтата (III) калия и натрия.
Материальное обеспечение: пробирки, пипетки, раствор хлорида калия, раствор гексанитрокобальтата (III) натрия.
Ход работы:
1.Поместить в пробирку 4 капли соли хлорида калия.
2.Добавить 3 капли раствора натрия гексанитрокобальтата (III).
3.Дать смеси постоять 2-3 минуты.
4.Отметить цвет образовавшегося осадка.
5.Составить уравнение соответствующей реакции в молекулярном и ионном виде.
6.Сделать вывод относительно использования данной реакции для осаждения ионов К+ в сыворотке крови при перманганатометрическом определении ионов К+ в крови.
Опыт №2.
Открытие иона Са2+ действием реактива оксалата аммония (NH4)2C2O4.
Принцип метода: метод основан на реакции взаимодействия солей кальция с оксалатом аммония, в результате которой образуется белый
16
мелкокристаллический осадок оксалата кальция СаС2О4, не растворимый в уксусной кислоте, но растворимый в азотной и соляной кислотах.
Материальное обеспечение: пробирки, пипетки, раствор хлорида кальция, раствор оксалата аммония (NH4)2C2O4, раствор уксусной кислоты, раствор азотной кислоты, раствор соляной кислоты.
Ход работы:
1.Поместить в пробирку 6 капель раствора хлорида кальция.
2.Добавить 6 капель реактива оксалата аммония (NH4)C2O4.
3.Отметить характер и цвет образовавшегося осадка оксалата кальция.
4.Разделить образовавшийся осадок на 3 пробирки поровну.
5.Добавить в первую пробирку избыток раствора уксусной кислоты.
6.Внести во вторую пробирку избыток раствора азотной кислоты.
7.Добавить в третью пробирку избыток раствора соляной кислоты.
8.Сделать вывод относительно растворимости осадка оксалата кальция в кислотах.
9.Составить уравнения соответствующих реакций в молекулярном и ионном виде.
10.Отметить в лабораторном журнале вывод о возможности применения данной аналитической реакции для осаждения ионов кальция при определении содержания Са2+в моче и крови перманганатометрическим методом.
Опыт №3.
Открытие иона Mg2+действием реактива натрия гидрофосфата
Na2HPO4.
Принцип метода: метод основан на реакции взаимодействия между гидрофосфатом натрия Na2HPO4 и ионами магния в присутствии гидроксида аммония и хлорида аммония, в результате которой образуется белый кристаллический осадок фосфата аммония-магния.
Материальное обеспечение: пробирки, пипетки, раствор гидрофосфата натрия Na2HPO4, раствор хлорида аммония, 2М раствор гидроксида аммония, раствор хлорида магния.
Ход работы:
1.Поместить в пробирку 3 капли раствора хлорида магния.
2.Добавить по 2 капли растворов хлорида аммония и 2М раствора гидроксида аммония.
3.Внести в пробирку 2 капли раствора гидрофосфата натрия.
4.Отметить цвет образовавшегося осадка.
5.Составить уравнение соответствующей реакции в молекулярном и ионном виде.
6.Сделать вывод о возможности применения данной реакции для определения ионов магния в крови.
17
Опыт №4.
Действие сильных щелочей на соли алюминия и реакция открытия иона Al3+.
Принцип метода: метод основан на реакции осаждения едкими щелочами NaOH и КОН из раствора солей алюминия белого студенистого осадка гидроксида алюминия, растворимого как в кислотах, так и в щелочах.
Материальное обеспечение: пробирки, пипетки, раствор хлорида алюминия, раствор гидроксида натрия NaOH, раствор соляной кислоты HCl, хлорид аммония кристаллический, газовая горелка.
Ход работы:
1.Внести в пробирку 7 капель раствора хлорида алюминия.
2.Добавить по каплям раствор гидроксида натрия до образования осадка.
3.Разделить образовавшийся осадок на 2 пробирки.
4.Внести в первую пробирку несколько капель раствора соляной кислоты
HCl.
5.Внести во вторую пробирку несколько капель раствора гидроксида натрия NaOH.
6.Наблюдать растворение осадка в обеих пробирках.
7.Добавить во вторую пробирку, содержащую алюминат, несколько кристаллов хлорида аммония.
8.Прокипятить смесь до исчезновения запаха аммиака.
9.Отметить образование осадка гидроксида алюминия.
10.Составить уравнения соответствующих реакций в молекулярном и ионном виде.
11.Сделать вывод относительно применения данной аналитической реакции для открытия катионов алюминия.
Опыт №5.
Действие раствора иодида калия на соли свинца.
Принцип метода: метод основан на реакции взаимодействия раствора иодида калия с ионами свинца Pb2+, в результате которой образуется желтый осадок иодида свинца.
Материальное обеспечение: пробирки, пипетки, раствор ацетата свинца, раствор иодида калия.
Ход работы:
1.Внести в пробирку 5 капель раствора ацетата свинца Pb(CH3COO)2.
2.Добавить по каплям раствор иодида калия до выпадения осадка.
3.Составить уравнение соответствующей реакции в молекулярном и ионном виде.
4.Сделать вывод относительно применения данной реакции для обнаружения ионов свинца Pb2+.
18
Опыт №6.
Действие дифениламина на нитрат-ион NO3– .
Принцип метода: метод основан на окислении дифениламина (C6H5)2NH ионами NO3- до продукта, имеющего темно-синюю окраску.
Материальное обеспечение: часовое стекло, раствор дифениламина, раствор концентрированной серной кислоты, раствор нитрата натрия.
Ход работы:
1.Поместить на часовое стекло 4 капли раствора дифениламина.
2.Добавит 6 капель концентрированной серной кислоты H2SO4.
3.Внести в раствор 2 капли раствора нитрата натрия.
4.Наблюдать появление интенсивного синего окрашивания.
5.Сделать вывод о возможности использования данной реакции с целью идентификации нитрат-ионов в растворе.
Опыт №7.
Действие хлорида бария на тетраборат-анион В2О72-.
Принцип метода: метод основан на реакции осаждения хлоридом бария BaCl2 в концентрированных растворах буры белого осадка метабората бария Ba(BO2)2, растворимого в разбавленных соляной и азотной кислотах.
Материальное обеспечение: пробирки, пипетки, раствор хлорида бария, раствор тетрабората натрия Na2B4O7, раствор разбавленной соляной кислоты, раствор разбавленной азотной кислоты.
Ход работы:
1.Внести в пробирку 5 капель раствора буры Na2B4O7.
2.Добавить 6 капель раствора хлорида бария.
3.Отметить образование белого осадка метабората бария Ba(BO2)2.
4.Разделить образовавшийся осадок на 2 пробирки.
5.Добавить в первую пробирку избыток разбавленной соляной кислоты
HCl.
6. Внести во вторую пробирку избыток разбавленной азотной кислоты
HNO3.
7.Наблюдать растворение осадка метабората бария в разбавленных соляной и азотной кислотах.
8.Составить уравнения соответствующих реакций в молекулярном и ионном виде.
9.Сделать вывод относительно возможности применения данной реакции для идентификации тетраборат-аниона.
Опыт №8.
Действие перманганата калия на оксалат-ион С2О42-.
Принцип метода: метод основан на реакции окисления перманганатом калия KMnO4 оксалат-ионов С2О42- в присутствии серной кислоты при слабом нагревании в угольный ангидрид СО2, восстанавливаясь при этом до бесцветного иона Mn2+.
19
Материальное обеспечение: пробирки, пипетки, раствор оксалата аммония (NH4)2C2O4, раствор серной кислоты, раствор перманганата калия KMnO4, газовая горелка.
Ход работы:
1.Внести в пробирку 5 капель раствора оксалата аммония.
2.Добавить 6 капель раствора серной кислоты.
3.Смесь слегка нагреть.
4.Добавить к полученному раствору по каплям раствор перманганата
калия.
5.Наблюдать обесцвечивание раствора.
6.Составить уравнение окислительно-восстановительной реакции.
7.Расставить коэффициенты в данной ОВР методом полуреакций.
8.Сделать вывод относительно применения данной реакции для доказательства присутствия оксалатов в анализируемом растворе.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Основу всех живых систем составляют шесть элементов-органогенов. Определите эти элементы.
A.C, N, As, B, Al, Cl;
B.H, P, S, C, O, N;
C.O, Cl, Na, K, Ca, Mg;
D.H, F, Br, Bi, As, I;
E.O, K, Li, B, F, Se.
Задание 2.
Один из s-элементов расположен в периодической системе Д.И. Менделеева под порядковым номером 12. Укажите электронную конфигурацию, которая отвечает этому элементу.
A.1s22s22p63s23p1;
B.1s22s22p63s2;
C.1s22s22p63s1;
D.1s22s22p1;
E.1s22s22p3.
Задание 3.
Фосфор – незаменимый элемент, входящий в состав гидрофосфат- и дигидрофосфат-ионов фосфатной буферной системы организма. Укажите электронную конфигурацию, которая отвечает атому фосфора в составе этих ионов.
A.1s22s22p63s23p64s1;
B.1s22s22p63s23p4;
C.1s22s22p6;
20
