
КНИЖЕЧКАметод_указ_мед_химия
.pdfКОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать растворы как многокомпонентные системы.
2.Интерпретировать моляльную концентрацию и молярную концентрацию эквивалента.
3.Интерпретировать окислительно-восстановительные реакции.
4.Трактовать метод пермангатометрии и его применение в медицине.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1. Общие сведения о растворах, способы выражения количественного состава растворов. Моляльная концентрация (Сm), молярная концентрация эквивалента (Сэкв).
2.Окислительно-восстановительные реакции. Основные окислители и восстановители. Метод электронного баланса.
3.Метод перманганатометрии. Молярная концентрация эквивалента окислителей и восстановителей.
4.Применение метода перманганатометрии в клиническом анализе и в санитарно-гигиенических исследованиях.
41
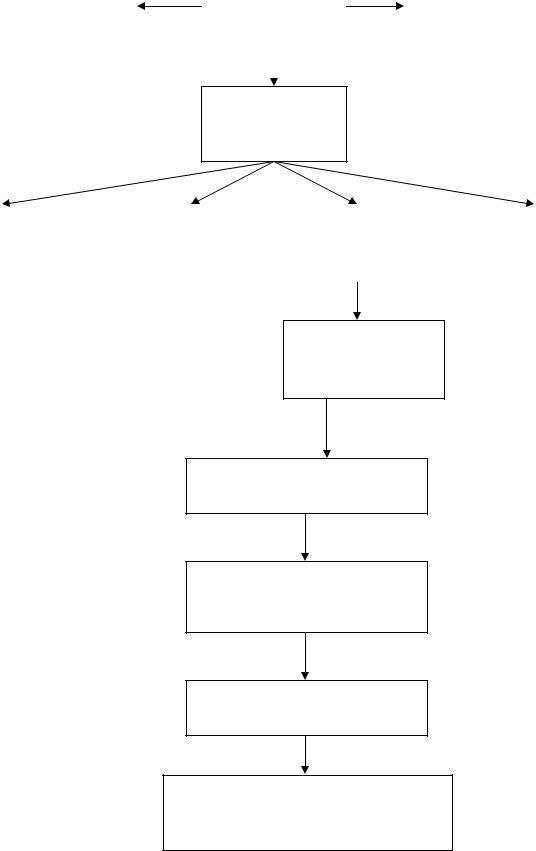
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
Растворимое |
|
РАСТВОРЫ |
|
Растворитель |
вещество |
|
|
|
|
|
|
|
|
|
Способы
выражения
концентраций
Массовая |
|
Моляльная |
|
Молярная |
|
Молярная |
доля |
|
концентрация |
|
концентрация |
|
концентрация |
раствора |
|
|
|
эквивалента |
|
|
|
|
|
|
|
|
|
Молярная масса эквивалента окислителя
Метод объемного анализа. Перманганатометрия
Титриметрическое определение объема окислителя
Расчет концентрации восстановителя
Применение методом титриметрического анализа в лабораторной практике
42
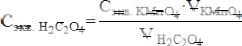
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2006. – С. 90-92; 95-98; 191-207; 336-344.
2.Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И.,
Галинская В.И. и др. – К.: Медицина, 2008. – С. 209-215; 116-118.
Дополнительная литература.
3.К.А. Селезнёв. Аналитическая химия. М.: «Высшая школа», 1973. –
С.72-73, 78-79, 85, 90-91, 108, 142-143, 153.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1. Определение концентрации восстановителя методом перманганатометрии.
Принцип метода: метод основан на использовании окислительновосстановительного титрования.
Материальное обеспечение: бюретка, колбы для титрования, пипетки, мерный цилиндр, водяная баня, раствор калия перманганата (Сэкв.=0,01М), раствор щавелевой кислоты, раствор серной кислоты, дистиллированная вода.
Ход работы:
1.Бюретку промыть раствором калия перманганата Сэкв. = 0,01 моль/л и довести уровень раствора в ней до «0» (правило мениска).
2.В колбу для титрования отмерить точно заданный объем восстановителя
(VH2C2O4) и прибавить к нему 2 мл раствора серной кислоты.
3.Нагреть на водной бане.
4.Провести титрование восстановителя раствором калия перманганата, прибавляя его из бюретки по каплям (последующую каплю прибавляем после полного обесцвечивания предыдущей).
5.В точке эквивалента определяем по шкале бюретки объем раствора
KMnO4 – (V KMnO4)
6.Повторить титрование еще дважды и рассчитать средний объем раствора KMnO4, который пошел на титрование.
7.Рассчитать концентрацию раствора H2C2O4 по формуле:
где Сэкв.H2C2O4 – молярная концентрация эквивалента щавелевой кислоты, моль/л;
Сэкв.KMnO4 – молярная концентрация эквивалента раствора калия перманганата, моль/л;
VKMnO4 – среднее арифметическое значение объема KMnO4, мл; VH2C2O4 – объем щавелевой кислоты взятой на титрование, мл.
43
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Растворы играют важную роль в жизни человека. Укажите, какой фактор влияет на растворимость твердых веществ.
A.Давление;
B.Величина поверхности твердого вещества;
C.Природа растворителя;
D.Объем раствора;
E.Влажность воздуха.
Задание 2.
Важной характеристикой растворов является их концентрация. Укажите тип концентрации, которая определяет число молей растворенного вещества, содержащегося в 1000 мл раствора.
A.молярная концентрация эквивалента;
B.массовая доля;
C.моляльная концентрация;
D.объемная доля;
E.мольная доля.
Задание 3.
Перманганатометрию используют в клинических лабораториях для определения в крови ионов кальция. Укажите кислоту, которую необходимо использовать для создания кислой среды при титровании данным методом.
A.HNO3;
B.HNO2;
C.H2SO4;
D.HCl;
E.H3PO4.
Задание 4.
Окислительные свойства водного раствора KMnO4 используют для обезвреживания токсичных органических веществ. Укажите, при каких условиях можно определить концентрацию восстановителей в растворе.
A.Только при нагревании;
B.Можно в кислой среде;
C.Можно в нейтральной среде;
D.Нельзя;
E.Только при перемешивании раствора.
Задание 5.
Перманганатометрию используют для определения количества органических примесей в воде. Укажите, сколько граммов KMnO4 нужно взять
44
для приготовления 500 мл раствора с молярной концентрацией эквивалента 0,2 моль-экв/л.
A.9,48;
B.7,90;
C.6,32;
D.3,16;
E.1,58.
Задание 6.
По количеству окисленного перманганата определяют содержание примесей в питьевых и сточных водах. Укажите способ фиксирования точки эквивалентности в методе перманганатометрии.
A.Индикатор – фенолфталеин;
B.Раствор крахмала;
C.Индикатор – лакмус;
D.Безиндикаторный способ;
E.KMnO4.
Задание 7.
Окислительно-восстановительная реакция протекает по схеме
P + HNO3 + H2O → H3PO4 + NO
Укажите сумму коэффициентов в правой части этой реакции.
A.18;
B.10;
C.9;
D.8;
E.5.
Задание 8.
Для идентификации H2O2 в фармакопейном анализе применяют метод перманганатометрии. Укажите, титрованием какого раствора устанавливают точную концентрацию KMnO4.
A.Азотная кислота;
B.Серная кислота;
C.Щавелевая кислота;
D.Соляная кислота;
E.Гидроксид натрия.
Задание 9.
В диагностических целях в клинической медицине применяют методы количественного анализа. Укажите, невозможность при титровании методом перманганатометрии использования HNO3.
A.Разлагается при нагревании;
B.Является сильным окислителем;
C.Окрашивает раствор в розовый цвет;
45
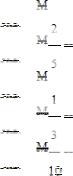
D.Не позволяет определить точку эквивалента;
E.Является сильной кислотой.
Задание 10.
В основе метода перманганатометрического титрования лежит реакция взаимодействия KMnO4 с щавелевой кислотой в кислой среде:
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10CO2 + 8H2O
MnO4- + 8H+ +5е → Mn+2 + 4H2O |
×2 |
H2C2O4 –2 е → 2CO2 + 2H+ |
×5 |
Укажите формулу расчета в моль-экв/дм3 окислителя в данной реакции.
A.





 ;
;
B.





 ;
;
C.





 ;
;
D.





 ;
;
E.





 .
.
Эталоны ответов. |
|
|
|
|
1 |
– C; |
5 |
– D; |
9 – B; |
2 |
– A; |
6 |
– E; |
10 – B. |
3 |
– C; |
7 |
– B; |
|
4 |
– B; |
8 |
– C; |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
Вначале занятия осуществляется определение уровня подготовки студентов
кзанятию при помощи фронтальной беседы.
Следующим этапом является выполнение лабораторной работы с использованием приведенной инструкции. После завершения практической части, студенты оформляют протокол, в который вносят уравнения проведенных реакций и наблюдаемые при поведении опытов аналитические сигналы. После выполнения лабораторной работы, студенты выполняют самостоятельную работу путем решения ситуационных задач по теме: «Растворы. Перманганатометрия как метод объемного количественного анализа».
Далее происходит анализ и коррекция знаний студентов путем рассмотрения теоретических вопросов решения обучающих задач.
Следующим этапом проводится тестовый контроль знаний студентов по теме: «Растворы. Перманганатометрия как метод объемного количественного анализа» с использованием тестов формата А. Занятие заканчивается
46

подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля, и осуществляется проверка протоколов выполненной лабораторной работы.
КОМПЛЕКСООБРАЗОВАНИЕ В БИОЛОГИЧЕСКИХ СИСТЕМАХ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Комплексные соединения играют большую роль при изучении биологически-активных соединений, знание которые необходимо для понимания механизмов биохимических процессов, проходящих в организме человека. Например, было установлено, что некоторые витамины в комплексах с кобальтом, медью, марганцем, никелем заметно увеличивают свою физиологическую активность. Гемоглобин, хлорофилл зеленых растений, витамин В12 представляют собой комплексные соединения, знание свойств которых необходимо при изучении биологии, биохимии и клинических дисциплин.
В настоящее время комплексные соединения широко применяются в клиниках (хелатотерапия отравлений солями тяжелых металлов, таких как ртуть, свинец), в сельском хозяйстве (удобрения, средства защиты растений от различных болезней), в клинических и санитарно-гигиенических исследованиях (комплексонометрия).
Комплексонометрия – это метод объёмного анализа, в котором в качестве титрованных растворов применяют органические реагенты – комплексоны, представляющие собой аминополикарбоновые кислоты. Чаще всего применяется комплексон Ш или трилон Б (дигидрат натриевой соли этилендиаминтетрауксусной кислоты). Важной характеристикой его свойств является способность мгновенно образовывать прочные, растворимые в воде внутрикомплексные соединения почти со всеми катионами. На этом принципе основан метод определения жесткости воды, широко применяемый в санитарно-гигиенических лабораториях, на фильтровальных станциях и т.д.
Жесткость воды – один из основных показателей качества водопроводной воды. Жесткость воды делится на 3 вида: временную, постоянную и общую. Временная жесткость воды обусловлена присутствием гидрокарбонатов, которые разрушаются при кипячении.
t
Ca(HCO3)2 CaCO3 + CO2 + H2O
t
Mg(HCO3)2  MgCO3 + CO2 + H2O
MgCO3 + CO2 + H2O
Постоянная жесткость обусловлена присутствием растворимых солей кальция и магния, которые не образуют осадка при кипячении. Общая жесткость – это сумма временной и постоянной жесткости. Она выражается суммой миллиграмм-эквивалентов ионов кальция и магния в 1 литре воды и может колебаться в следующих пределах:
− до 4 единиц – вода мягкая;
47
−4-8 единиц – вода средней жесткости;
−8-12 единиц – вода жесткая;
−свыше 12 единиц – вода очень жесткая.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь интерпретировать строение и свойства комплексных соединений, понятия нестойкости, устойчивости, образования и диссоциации комплексных соединений, а также применять метод комплексонометрии для определения жесткости водопроводной воды.
КОНКРЕТНЫЕ ЦЕЛИ.
УМЕТЬ:
1.Идентифицировать строение комплексных соединений в соответствии с основными положениями координационной теории Вернера.
2.Интерпретировать природу химической связи в комплексных соединениях.
3.Интерпретировать классификацию и номенклатуру комплексных соединений.
4.Интерпретировать образование и диссоциацию комплексных соединений.
5.Интерпретировать понятие жесткости воды и определять общую жесткость воды.
6.Трактовать химические основы применения комплексных соединений в медицине и биологии.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Основные положения координационной теории Вернера. Структура комплексных соединений: центральный атом, координационное число, лиганды, их дентантность, комплексный ион, внутренняя и внешняя сферы комплексных соединений.
2.Номенклатура и классификация комплексных соединений по заряду комплексного иона и сущности лигандов.
3.Природа химической связи в комплексных соединениях.
4.Равновесие в растворах комплексных соединений, константа нестойкости и константа устойчивости комплексных соединений.
5.Механизм образования хелатных комплексов на примере образования хелатного комплекса Са2+ с трилоном Б.
6.Использование метода комплексонометрии для определения общей жесткости воды.
7.Хелатный эффект. Применение трилона Б и других комплексонов в качестве антидотов при отравлениях солями тяжелых металлов.
48
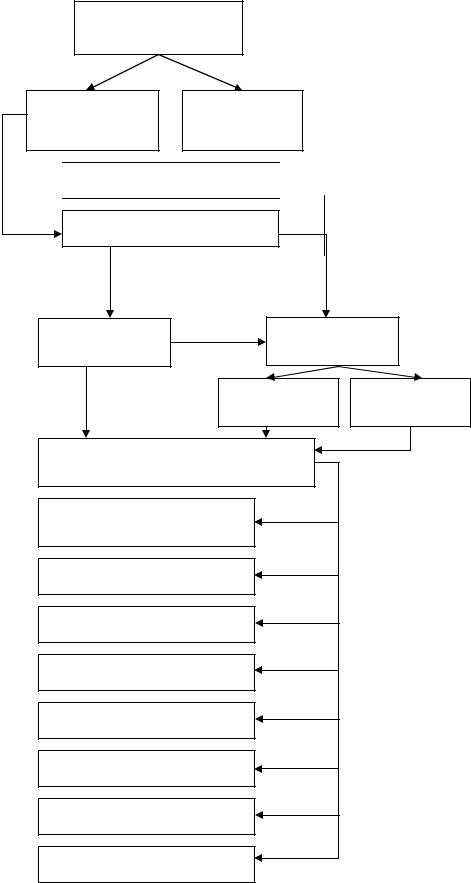
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
Комплексные
соединения
Внутренняя |
Внешняя |
сфера |
сфера |
Структура
 Комплексообразователь
Комплексообразователь 
Лиганды
Свойства
Медикобиологическое значение
Дентантность Устойчивость
Константа Константа
нестойкости устойчивости
Комлексоны
Санитарно-
гигиенические
Клинические
Сельское хозяйство
Терапия
Биохимия
Фарм. химия
Биология
Физиология
49
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 46-57, 63-68, 72-84, 359-363.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 43-54.
Дополнительная литература.
3.Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 107-113, 206-208.
4.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 251-271.
5.Н.И. Михайличенко. Общетеоретические основы химии. – К.: Высшая школа, 1979. – С. 87-103.
6.Ершов Ю.А., Попков В.А., Берлянд А.З. Общая химии. Биофизическая химия. Химия биогенных элементов. Учебник для ВУЗов. – М.: Высшая школа,
2000. – С. 191-203.
7. К.А. Селезнёв. Аналитическая химия. М.: «Высшая школа», 1973. – С. 55-57, 58-59, 60-62.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1.
Получение гидроксокомплексов алюминия и цинка.
Принцип метода: метод основан на образовании белых осадков гидроксидов цинка и алюминия, растворимых в избытке щелочи с образованием комплексных соединений.
Материальное обеспечение: 2 часовых стекла, пипетки, раствор сульфата цинка, раствор сульфата алюминия, раствор едкого натра.
Ход работы:
1.Нанести на 2 часовых стекла по 6-8 капель растворов сульфата цинка и сульфата алюминия.
2.Ввести по 3-4 капли раствора едкого калия KOH.
3.Наблюдать образование белых осадков гидроксида цинка и гидроксида алюминия.
4.К каждому осадку добавить ещё по 5-6 капель раствора KOH.
5.Наблюдать растворение осадков.
6.Составить уравнения соответствующих реакций.
7.Обозначить комплексообразователи и лиганды соответствующих комплексных ионов.
8.Определить к какому типу относятся полученные комплексы – катионные или анионные.
50
