
КНИЖЕЧКАметод_указ_мед_химия
.pdfКИНЕТИКА БИОХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Все процессы, которые происходят вокруг нас и внутри нас, идут с преобразованием энергии и с разной скоростью. Большое практическое значение химической кинетики состоит в том, что она разрешает определять, возможен или невозможен тот или иной процесс, и в каких условиях он происходит.
Положения химической кинетики, которая изучает скорости и механизмы реакций, с большим успехом применяются для изучения биохимических процессов. Кинетика ферментативных процессов играет большую роль в живой природе и нужна студентам для следующих дисциплин: биохимии, фармакологии, физиологии.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь объяснять механизмы и скорости биохимических процессов, которые происходят в организме человека.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать гомогенные и гетерогенные реакции, порядок и молекулярность реакций.
2.Рассчитывать скорость химических реакций на основании закона действующих масс и при изменении температуры.
3.Интерпретировать константу скорости реакции, её физический смысл.
4.Интерпретировать понятие энергии активации, теорию активных столкновений, уравнение Аррениуса.
5.Интерпретировать гомогенный и гетерогенный катализ, понятие о роли ферментов в организме.
6.Трактовать константу равновесия на основании закона действующих масс для равновесной системы и направление смещения равновесия по принципу Ле-Шателье.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Предмет изучения химической кинетики. Определение и математическое выражение скорости реакции. Порядок и молекулярность реакций.
2.Факторы, влияющие на скорость реакции: концентрация, температура. Закон действующих масс. Константа скорости. Правило Вант-Гоффа.
3.Теория активных столкновений. Энергия активации. Уравнение Аррениуса.
91
4.Гомогенный и гетерогенный катализ. Понятие о ферментативном катализе в биологических системах.
5.Необратимые и обратимые реакции. Закон действующих масс для состояния химического равновесия. Направление смещения равновесия по принципу Ле-Шателье.
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 420-428; 434-441; 457-459; 462-467; 476-477.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник – К.: Медицина, 2008. – С. 82-105.
Дополнительная литература.
3.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 140-156.
4.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 140-166.
5.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 101-109; 115-131.
6.Н.И. Михайличенко. Общетеоретические основы химии. – К.: Высшая школа, 1979. – С. 140-178.
92
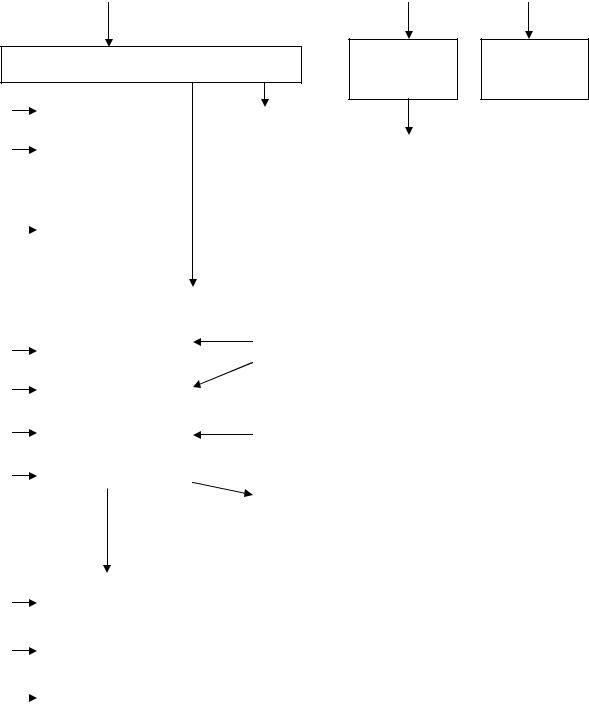
3. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
ХИМИЧЕСКАЯ КИНЕТИКА |
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
|
|
|
Закон
Химические реакции действующих
масс
|
|
|
|
|
гомогенные |
|
|
|
|
|
|
|
|
|
|
|
|
|
классификация |
|
|
|
|
|
Теория |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
активных |
|
|
|
|
|
|
|||
|
|
|
|
|
гетерогенные |
|
|
|
|
Константа |
|||||||
|
|
|
|
|
|
|
столкновений |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
равновесия |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
молекулярность |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
порядок реакций |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
скорость реакции |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
на |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
концентрация |
|
|
|
|
закон действующих масс |
|||||||||
,влияющиеФакторы скорость |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
ферменты |
|||||||
|
|
|
давление |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
константа скорости |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
температура |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
правило Вант-Гоффа |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
катализаторы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
классификация |
|
|
катализ |
|
|
||
|
|
|
|
|
|
|
|
|
|
гомогенный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гетерогенный |
|
|
|
|
|
|
|
|
Правило ЛеШательє
93
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1. Зависимость скорости химической реакции от концентрации
Принцип метода: метод основан на определении времени образования опалесценции, обусловленной образованием серы в ходе реакции:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
Материальное обеспечение: секундомер, штатив с пробирками, пипетки, растворы: серной кислоты (2М), тиосульфата натрия (0,01М).
Ход работы:
1. |
Приготовьте три раствора тиосульфата натрия разных концентраций. |
|||||||
Для этого в три сухие пробирки внесите: |
|
|
|
|
|
|||
|
|
1) в первую: 4 капли 0,01М раствора Na2S2O3 и 8 капель воды; |
|
|
|
|||
|
|
2) во вторую: 8 капель 0,01М раствора Na2S2O3 и 4 капли воды; |
|
|
|
|||
|
|
3) в третью: 12 капель 0,01 М раствора Na2S2O3. |
|
|
|
|
||
2. |
В первую пробирку добавьте 1 каплю 2М раствора H2SO4. |
|||||||
Одновременно включите секундомер. |
|
|
|
|
|
|||
3. |
Определите время от момента добавления кислоты до появления в |
|||||||
растворе заметной опалесценции. |
|
|
|
|
|
|||
4. |
Проведите аналогичные опыты со 2-ой и 3-ей пробирками. |
|
|
|
|
|||
5. |
Заполните таблицу: |
|
|
|
|
|
||
|
№ пробирки |
Концентрация Na2S2O3, |
Время прохождения |
V= 1/t, |
с |
-1 |
|
|
|
относительные единицы |
реакции, сек |
|
|
||||
|
|
|
|
|
|
|
||
|
|
1. |
1/3 |
|
|
|
|
|
|
|
2. |
2/3 |
|
|
|
|
|
|
|
3. |
1 |
|
|
|
|
|
6. |
Начертите |
график зависимости скорости реакции от концентрации |
||||||
реагирующих веществ. На оси абсцисс отложите концентрации Na2S2O3, на оси ординат – соответствующие им скорости: V=1/t, с-1, где t – время прохождения реакции.
7. Сделайте вывод о зависимости скорости реакции от концентрации.
Опыт №2. Влияние температуры на скорость реакции
Принцип метода: метод основан на правиле Вант-Гоффа об увеличении скорости реакции в 2-4 раза при повышении температуры на каждые 10 градусов.
Материальное обеспечение: термометр на 100° С, стакан объемом 100 мл с крышкой, в которой имеются отверстия для пробирок и термометра, пипетки, секундомер, растворы: серной кислоты (2М), тиосульфата натрия (2М).
Ход работы:
1.В три пробирки внесите по 10 капель 1М раствора H2SO4.
2.Вставьте пробирки в отверстия крышки стакана с водой.
3.Измерьте температуру воды и добавьте в одну из пробирок 1 каплю 2М раствора H2SO4.
94
4.Определите время до появления в растворе заметной опалесценции.
5.Добавьте горячей воды в стакан до повышения температуры на 10° С.
6.Добавьте во вторую пробирку 1 каплю 2М раствора H2SO4.
7.Определите время протекания реакции.
8.Повысьте температуру еще на 10° С.
9.Аналогично проведите опыт в третьей пробирке.
10.Постройте график зависимости скорости реакции от температуры.
11.Сделайте соответствующий вывод.
Опыт №3. Влияние концентраций реагирующих веществ на химическое равновесие
Принцип метода: метод основан на принципе Ле-Шателье о сдвиге равновесия при изменении концентрации реагирующих веществ.
Материальное обеспечение: штатив с пробирками, пипетки, стеклянные палочки, растворы: хлорида железа (III) (0,00254М), роданида калия (0,0025М), насыщенные растворы хлорида железа (III) и роданида калия, кристаллический хлорид калия.
Ход работы:
1.В четыре пробирки внесите по 5-7 капель 0,0025М раствора FeCl3 и добавьте в них по 5-7 капель 0,0025М раствора KCNS.
2.Содержимое пробирок перемешайте стеклянной палочной.
3.Одну пробирку оставьте для сравнения (контроль).
4.В остальные пробирки добавьте: в первую – 1 каплю насыщенного
раствора FeCl3; во вторую – 1 каплю насыщенного раствора KCNS; в третью – несколько кристаллов KCl.
5.Сравните интенсивность окраски растворов с раствором в контрольной пробирке.
6.Напишите уравнение обратимой реакции.
7.Напишите выражение для константы равновесия.
8.Заполните таблицу:
№ |
наблюдение за изменением интенсивности окраски |
направление |
||
|
при добавлении |
|
смещения |
|
пробирки |
насыщенного |
насыщенного |
|
|
кристаллов KCl |
равновесия |
|||
|
раствора FeCl3 |
раствора KCNS |
|
|
1. |
|
|
|
|
2. |
|
|
|
|
3. |
|
|
|
|
контроль |
|
|
|
|
95
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
В организме человека реакция окисления этанола идет по уравнению:
С2Н5ОН + О2 → СН3СООН+ Н2О Как изменится скорость реакции, если увеличить концентрацию исходных
веществ в 5 раз?
A.Уменьшится в 5 раз;
B.Уменьшится в 10 раз;
C.Увеличится в 10 раз;
D.Увеличится в 5 раз;
E.Увеличится в 25 раз.
Задание 2.
Под влиянием ферментов сахароза в организме человека превращается в глюкозу и фруктозу. Как изменится скорость этой реакции при увеличении температуры на 20° С (γ = 3)?
A.Уменьшится в 3 раза;
B.Уменьшится в 9 раз;
C.Увеличится в 6 раз;
D.Увеличится в 9 раз;
E.Увеличится в 27 раз.
Задание 3.
Для характеристики смещения равновесия биохимических процессов пользуются значением величины константы равновесии Кр. Укажите фактор, от которого зависит эта константа.
A.Концентрации реагирующих веществ;
B.Давления;
C.Катализатора;
D.Энергии активации;
E.Природы реагирующих веществ и температуры.
Задание 4.
В организме человека окисление глюкозы протекает по уравнению
С6Н12О6 + 6О2 → 6СО2 + Н2О Укажите кинетическое уравнение скорости этой реакции.
A.v= [С6Н12О6] [О2] 6;
B.v= K[С6Н12О6] [О2] 6;
C.v= K[С6Н12О6] [6О2];
D.v=[ С6Н12О6] [6О2];
E. 



 .
.
96
Задание 5.
В химической кинетике есть такое понятие как порядок реакции. Укажите, чему равен этот показатель в реакции
CuO(т) + H2(г) = Cu(т) + Н2О
A.0;
B.1;
C.2;
D.3;
E.4.
Задание 6.
Сероводород, который является ядом для человека, окисляется по реакции
2H2S + ЗО2 ↔ 2SO2 + Н2О
Укажите, во сколько раз увеличится скорость этой реакции при повышении давления в системе в 4 раза.
A.4
B.64
C.124
D.924
E.1024
Задание 7.
Гидрокарбонат натрия, применяющийся в медицине при ацидозе, подвергается гидролизу по реакции:
NaHCO3 + H2O ↔ H2CO3 + NaOH
Определите константу равновесия (Кр) этой реакции на основании закона действующих масс.
A.



 ;
;
B.



 ;
;
C.



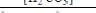 ;
;
D.



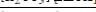 ;
;
E. 



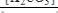 .
.
Задание 8.
Скорость реакции увеличивается с повышением температуры. Укажите, во сколько раз она увеличится при повышении температуры реакции на 30° С , если температурный коэффитиент γ = 3.
A.3;
B.9;
C.12;
D.27;
E.81.
97
Задание 9.
Ферменты – вещества белковой природы, которые управляют всеми биологическими функциями организма. Укажите температурный оптимум действия этих веществ в живом организме в градусах.
A.0-10
B.15-20
C.35-40
D.65-70
E.90-95
Задание 10.
Процесс фотосинтеза глюкозы в присутствии природного катализатора – хлорофилла идет по схеме:
6CO2 + 6H2O ↔ C6H12O6 + 6O2
Укажите кинетическое уравнение этой реакции.
A.v = [CO2] 6∙[H2O] 6;
B.v = [6CO2]∙[6H2O ];
C.v = k[6CO2]∙[6H2O];
D.v = k[CO2]6∙[H2O]6;
E.v = k[CO2]6∙[H2O].
Эталоны ответов. |
|
|
|
1 – E; |
5 |
– B; |
9 – C; |
2 – B; |
6 |
– E |
10 – D. |
3 – E; |
7 |
– D; |
|
4 – B; |
8 |
– D; |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия осуществляется проверка подготовки студентов к самостоятельной работе путем фронтального опроса. Студенты решают обучающие задачи, разбирают и закрепляют теоретический материал: идентифицируют гомогенные и гетерогенные реакции, рассчитывают скорость химической реакции, определяют константу равновесия на основании закона действующих масс.
Далее студенты выполняют самостоятельную работу. Использую инструкцию к лабораторно-практическому занятию, они выполняют опыты и оформляют протокол лабораторной работы.
После завершения лабораторной работы проводится анализ и коррекция знаний студентов. Следующим этапом является проведения тестового контроля знаний студентов по теме «Химическая кинетика. Химическое равновесие» с использованием тестов формата А.
98
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля и осуществляется проверка протоколов выполненной лабораторной работы.
СОРБЦИЯ БИОЛОГИЧЕСКИ-АКТИВНЫХ ВЕЩЕСТВ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Поверхностные явления – это процессы, которые проходят на границе двух фаз и зависят от особенностей и структуры поверхности.
Клетки, которые являются основой строения живых организмов, имеют очень большую поверхность распределения, на которой происходит большое количество биологических процессов. Взаимодействие ферментов с субстратами, антител с антигенами, поляризация и деполяризация биологических мембран – все эти явления можно объяснить на основе адсорбционных процессов.
В медицине широко применяют адсорбционную терапию. Например, разные адсорбенты используют для связи токсинов, нежелательных веществ, радиоактивных соединений и их вывод из организма. В основе одного из самых современных методов лечения – гемосорбции, очистка крови от токсинов с помощью разных адсорбентов, лежит механизм молекулярной адсорбции. В медицинской практике этот метод применяется при почечной и печеночной недостаточности, при сильных отравлениях. В медицинской практике широко применяются катионообменные смолы для декальцинирования крови с целью ее консервирования. Жидкие ионообменные смолы являются эффективными пролонгаторами некоторых лекарственных соединений, которые слишком быстро разрушаются в жидких средах организма, как большинство антибиотиков. В основе действия пролонгаторов лежит присоединение лекарственного вещества к матрице полимера по ионообменному механизму.
Широкое применение находят иониты в фармацевтической и биохимической промышленности. Это получение и очистка лекарств и биохимически активных веществ. Таким образом, знание свойств поверхностно
– активных веществ помогает глубокому изучению биохимических и физиологических процессов, происходящих в организме.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь трактовать особенности строения поверхности раздела фаз, строение молекул поверхностно – активных веществ, структуру биологических мембран.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1. Интерпретировать понятия поверхностные явления, поверхностная энергия, поверхностное натяжение.
99
2.Интерпретировать поверхностно-активные и поверхностно-инактивные вещества.
3.Интерпретировать сорбционные процессы.
4.Интерпретировать процесс адсорбции, анализировать влияние различных факторов на данный процесс.
5.Трактовать роль адсорбции в биологических системах и основы адсорбционной терапии.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Поверхностные явления. Поверхностная энергия и поверхностное натяжение на поверхности раздела фаз. Поверхностно-активные и поверхностно-инактивные вещества (ПАВ и ПИВ). Правило Дюкло-Траубе. Уравнение Шишковского.
2.Сорбционные процессы: адсорбция, абсорбция, хемосорбция. Адсорбенты и адсорбтивы.
3.Адсорбция на поверхности раздела жидкость – газ и жидкость – жидкость. Уравнение Гиббса. Ориентация молекул ПАВ в поверхностном слое. Представление о структуре биологических мембран.
4.Адсорбция на поверхности раздела твердое тело – газ. Уравнение Ленгмюра. Физическая и химическая адсорбция.
5.Закономерности адсорбции растворенных веществ, паров и газов. Уравнение Фрейндлиха.
6.Адсорбция ионов. Избирательная и ионообменная адсорбция. Правило Панетта-Фаянса. Ионообменники, их применение.
7.Роль адсорбции и ионного обмена в процессах жизнедеятельности растений и организмов. Физико-химические основы адсорбционной терапии (гемосорбция, плазмосорбция, лимфосорбция, энтеросорбция, аппликационная терапия). Иммуносорбенты.
100
