
КНИЖЕЧКАметод_указ_мед_химия
.pdfЗадание 9.
Гемоглобин – красящий пигмент крови, благодаря которому осуществляется транспорт кислорода в организме. Укажите элемент, который является комплексообразователем в этом соединении.
A.Железо;
B.Цинк;
C.Магний;
D.Кальций;
E.Натрий.
Задание 10.
В качестве антидота при отравлении солями тяжелых металлов применяют динатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА). Определите дентантность этого лиганда.
A.1;
B.2;
C.4;
D.5;
E.6.
Эталоны ответов. |
|
|
|
|
1 |
– D; |
5 |
– A; |
9 – A; |
2 |
– C; |
6 |
– B; |
10 – C. |
3 |
– A; |
7 |
– B; |
|
4 |
– A; |
8 |
– E; |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия осуществляется проверка уровня подготовки студентов к занятию путем фронтальной беседы.
После рассмотрения уровня подготовки к занятию, студенты решают учебные задачи по теме «Биогенные d-элементы, биологическая роль, применение в медицине». Следующим этапом является выполнение лабораторной работы с использованием приведенной инструкции. После завершения практической части, студенты оформляют протокол, в который вносят уравнения проведенных реакций и наблюдаемые при проведении опытов аналитические сигналы.
После завершения лабораторной работы, осуществляется анализ и коррекция знаний студентов путем рассмотрения особенностей электронного строения d-элементов, химических свойств d-элементов на примере соединений их отдельных представителей и медико-биологического значения d-элементов и их соединений.
Следующим этапом является проведение тестового контроля знаний студентов по теме «Биогенные d- элементы; биологическая роль, применение в медицине» с использованием тестов формата А.
31
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля и осуществляется проверка протоколов выполненной лабораторной работы.
РАСТВОРЫ. ЭЛЕКТРОФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Самыми распространенными системами человеческого организма являются растворы, в них происходят разнообразные физиологичные и биохимические процессы. Плазма крови, лимфа, моча, спинномозговая жидкость являются водными растворами в состав которых входят белковые компоненты, азотсодержащие соединения, углеводы, липиды и неорганические ионы (катионы натрия, калия, хлорид-ионы, гидрокарбонат-анионы и др.). Именно этим обусловлено широкое использование лекарственных средств в виде их водных растворов.
Биологические жидкости условно подразделяют на внутриклеточные и внеклеточные (плазма, лимфа), водно-солевой баланс которых определяется вопервых, концентрацией ионов и органических соединений, а во-вторых, работой физиологичных систем (почки, легкие, ЖКТ). Таким образом, одной из важнейших характеристик биологических жидкостей является концентрация растворенных компонентов, величина которой определяет нормальное или патологическое состояние организма.
Экспериментальное определение концентраций биологических жидкостей или растворов разнообразных лекарственных средств является важной стадией клинических и фармакологических исследований. При этом использование инструментальных методов является наиболее распространенным, преимущество которых заключается в небольшой трудоемкости в совокупности с большой точностью. Одним из таких методов является принцип непрямого определения концентрации по оптической плотности раствора – метод фотоэлектроколориметрии, в основе которого лежит закон Ламберта – Бугера - Бера.
При биохимических исследованиях данный метод используется для количественного определения общего содержания азота в моче (с реактивом Несслера), пировиноградной кислоты (метод Умбрайта), мочевины (метод Бородина), и т.д. Также фотоколориметрический метод дает возможность качественно определять амидопирин и кофеин, дикаин и новокаин в лекарственных смесях.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь трактовать механизм образования раствора, определять его тип и количественный состав.
32
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать механизм образования растворов.
2.Интерпретировать влияние температуры и природы компонентов раствора на растворимость.
3.Интерпретировать количественные характеристики состава раствора.
4.Интерпретировать понятие оптической плотности раствора и экспериментально определять концентрацию раствора по данной характеристике.
5.Трактовать биологические жидкости как многокомпонентные водные растворы.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Классификация растворов.
2.Механизм процессов растворения. Термодинамический подход к процессу растворения. Зависимость растворимости от температуры, природы растворенного вещества и растворителя.
3.Растворимость газов в жидкостях. Закон Генри-Дальтона. Растворимость газов в крови. Кессонная болезнь.
4.Величины, которые характеризуют количественный состав растворов (массовая концентрация, молярная концентрация).
5.Оптическая плотность растворов. Закон светопоглощения Ламберта – Бугера – Бера.
6.Роль растворов в жизнедеятельности организмов.
33
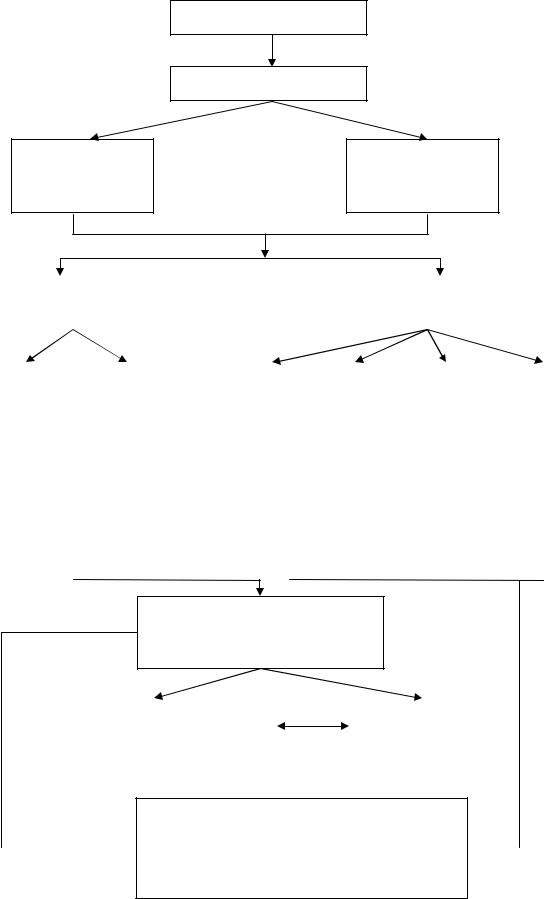
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
РАСТВОРЫ
Классификация
насыщенные; ненасыщенные; пересыщенные
концентрированные; разбавленные
Количественный |
|
Механизм образования |
состав растворов |
|
растворов |
|
|
|
Массовая ,,ωконцентрация% |
|
|
концентМолярная- ,Срация |
|
температурыВлияние |
|
природыВлияние веществарастворенного |
|
природыВлияние растворителя |
|
газовРастворимость -(Генризакон )Дальтона |
||||||
|
|
|
|
|
мольл/ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Экспериментальное определение концентрации растворов
оптическая плотность (закон |
|
фотоэлектро- |
Ламберта-Бугера-Бера) |
|
колориметрия |
|
|
|
Биологическое значение растворов и процессов растворения; определение  концентрации биологических жидкостей
концентрации биологических жидкостей  и лекарственных средств
и лекарственных средств
34
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 87-97, 100-111, 632.
2.Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 106-125.
Дополнительная литература.
3.Биофизическая химия. Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. – К.: Вища шк. Головное изд-во, 1986. – С. 41-49, 90-91.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 21-22, 25-27, 28-33.
5.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 157-169.
6.Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 142-146.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1. Определение массовой концентрации раствора меди (ІІ) сульфата фотоэлектроколориметрическим методом.
Принцип метода: метод основан на измерении оптической плотности окрашенного раствора CuSO4.
Материальное обеспечение: фотоэлектроколориметр (ФЭК), кюветы, фильтровальная бумага, дистиллированная вода, стандартные растворы CuSO4, растворы CuSO4 неизвестной концентрации.
Ход работы:
1.Включить ФЭК, прогреть его перед началом работы в течение 15 минут.
2.Налить в кюветы дистиллированную воду и поместить их в ФЭК.
3.Проверить показатели прибора, при необходимости выставить показатель на нулевую отметку.
4.Выключить прибор.
5.В кювету №2 налить раствор с наименьшей концентрацией раствора
CuSO4.
6.Протереть фильтровальной бумагой боковые стороны кюветы, чтобы удалить капли раствора.
7.Кювету поместить в прибор и включить его.
8.Записать значение оптической плотности раствора.
9.Выключить прибор.
10.Кювету №2 опустошить и промыть следующим раствором.
11.Используя п.6-п.9 измерить оптическую плотность всех растворов согласно их номерам, обозначенных на бутылках.
12.Полученные данные внести в таблицу:
35
№ |
Оптическая |
Молярная |
Массовая |
р- |
плотность |
концентрация |
концентрация |
ра |
d = lgIo/І |
СМ, моль/л |
ω, % |
|
|
|
|
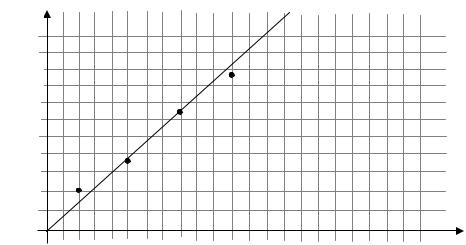
13. Используя экспериментальные данные, построить калибровочную прямую: по оси ОХ отложить значение молярной концентрации, по осе OY – значение оптической плотности растворов, затем усреднив полученные точки, провести прямую линию.
d
d4
d3
d2
d1
С1 С2 |
С3 |
СМ, моль/л |
С4 |
14.При помощи калибровочной прямой, определить неизвестные молярные концентрации растворов: на осе OY отложить экспериментально полученное значение d, провести прямую линию к калибровочной прямой и определить соответствующее значение СМ.
15.Рассчитать массовые концентрации растворов CuSO4 (ρ ≈ 1 г/мл).
16.Полученные данные занести в таблицу.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
При растворении 35,9г натрия хлорида в 100мл воды (при 20оС), была получена система, которая находится в равновесном состоянии с растворенным веществом. Определите тип данного раствора.
A.Разведенный;
B.Ненасыщенный;
C.Насыщенный;
D.Пересыщенный;
E.Твердый.
36
Задание 2.
При бытовой травме для мгновенной остановки кровотечения был использован раствор FeCl3 с концентрацией приблизительно 60%. Определите тип данного раствора.
A.Разведенный;
B.Концентрированный;
C.Газообразный;
D.Твердый;
E.Буферный.
Задание 3.
При растворении синих кристаллов CoCl2 наблюдается образование розового раствора. Определите процесс, который это объясняет.
A.Кристаллизация;
B.Перекристаллизация;
C.Диссоциация;
D.Ассоциация ионов;
E.Гидратация.
Задание 4.
В биохимической лаборатории с целью приготовления насыщенного раствора L-аспарагиновой кислоты было растворено 0,42г вещества в 100мл воды. Определите тип вещества по ее растворимости.
A.Высоко растворимое;
B.Хорошо растворимое;
C.Малорастворимое;
D.Практически нерастворимое;
E.Вообще нерастворимое.
Задание 5.
Для проведения клинических исследований необходимо приготовить раствор парафина. Укажите растворитель, который может быть для этого использован.
A.Вода;
B.Уксусная кислота;
C.Метанол;
D.Ацетон;
E.Бензол.
Задание 6.
Во время быстрого аварийного подъема водолаза с глубины на поверхность, в результате закупоривания кровеносных сосудов, наблюдается изменение цвета кожи и головокружение. Определите заболевание, признаки которого приведены.
A. Анемия;
37
B.Кессонная болезнь;
C.Базедова болезнь;
D.Диабет;
E.Болезнь Вильямса.
Задание 7.
В качестве противоаллергического средства было использовано 100г раствора кальция хлорида с массовой концентрацией 10%. Определите массу вещества и растворителя (в граммах), которые были необходимы для приготовления данного раствора.
A.20 и 80;
B.15 и 85;
C.10 и 90;
D.5 и 95;
E.1 и 99.
Задание 8.
Катионы К+ являются основными ионами внутриклеточной жидкости, концентрация которых составляет 0,15моль/л. Определите массу катионов калия (в граммах) в организме взрослого человека, если общий объем данной биологической жидкости приблизительно равен 27л.
A.158;
B.15,8;
C.1,58;
D.0,158;
E.0,0158.
Задание 9.
Для инъекционного введения лекарственного средства, был использован физиологический раствор NaCl с массовой концентрацией 0,9%, плотность которого равняется 1,0053г/мл. Рассчитайте молярную концентрацию (моль/л) данного раствора.
A.0,18;
B.0,17;
C.0,16;
D.0,15;
E.0,14.
Задание 10.
В ходе лабораторной работы методом фотоэлектроколориметрии была определена оптическая плотность раствора роданида железа (ІІІ), а затем установлена его молярная концентрация. Укажите уравнение, которое положено в основу данного метода.
A. 

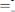












 ;
;
38
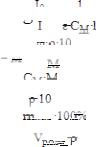
B.

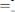





 ;
;
C.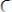




 ;
;
D.



 ;
;
E. 



 .
.
Задание 11.
У больного наблюдается образование отеков (накопление воды в межклеточном пространстве). Определите состояние водного баланса для последующего выбора курса лечения.
A.Нулевой;
B.Физиологичный;
C.Положительный;
D.Отрицательный;
E.Резко отрицательный.
Эталоны ответов. |
|
|
|
||
1 |
– |
С; |
5 – E; |
9 – C; |
|
2 |
– |
В; |
6 – B; |
10 – A; |
|
3 |
– E; |
7 |
– C; |
11 – C. |
|
4 |
– C; |
8 |
– A; |
|
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия осуществляется определение уровня самостоятельной подготовки студентов при помощи фронтального опроса.
Следующим этапом является решение учебных задач по теме «Растворы. Электрофотоколориметрический метод определения концентрации растворов». Затем выполняется лабораторная работа с использованием приведенной инструкции.
После завершения лабораторной работы происходит анализ и коррекция знаний студентов путем рассмотрения вопросов относительно механизма образования растворов, их классификации и влияния различных факторов на процессы растворения, а также рассматривается биологическая роль водных растворов.
Следующим этапом проводится тестовый контроль знаний студентов по теме «Растворы. Электрофотоколориметрический метод определения концентрации растворов» с использованием тестов формата А.
После завершение тестового контроля, студенты оформляют протокол лабораторной работы, в который вносят результаты фотоколориметрических измерений оптической плотности, строят калибровочную прямую и определяют молярные и массовые концентрации растворов CuSO4.
39
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля и осуществляется проверка протоколов выполненной лабораторной работы.
РАСТВОРЫ. ПЕРМАНГАНАТОМЕТРИЯ КАК МЕТОД ОБЪЕМНОГО КОЛИЧЕСТВЕННОГО АНАЛИЗА.
АКТУАЛЬНОСТЬ ТЕМЫ.
Метод перманганатометрии является одним из важнейших методов химического объемного анализа в аналитической химии. Химические реакции, используемые в объемном анализе, должны протекать быстро и количественно, т.е. до полного израсходования обоих взаимодействующих веществ. Конец реакции отвечает стехиометрическому уравнению между двумя реагирующими веществами. Вспомогательные реактивы, позволяющие установить конец реакции, называются индикаторами. В методе перманганатометрии роль индикатора выполняет сам перманганат калия. В кислой среде, при титровании, фиолетовый раствор перманганата обесцвечивается восстановителем. В эквивалентной точке обесцвечивание прекращается и одна лишняя капля перманганата окрашивает весь раствор в розовый цвет. Таким образом, легко установить конец реакции.
Быстрота объемно-аналитических определений дает возможность легко повторять их по нескольку раз и тем самым получать очень точные данные. Метод перманганатометрии дает возможность определить концентрацию раствора (молярную, нормальную, моляльную и процентную).
Такие науки как биология, биохимия, медицина, фармацевтическая химия тесно связаны с развитием учения о растворах, т.к. все биологические процессы, происходящие в растительном и животном мире, а также и организме человека, протекают в растворах. Метод перманганатометрии широко применяется при решении многих вопросов научного и практического характера т.к. этим методом может быть определено большое количество веществ. В клиническом анализе метод перманганатометрии применяется для определения в крови мочевой кислоты, кальция, калия и окислительного фермента каталазы; в санитарно-гигиеническом анализе – при исследовании питьевых и сточных вод. Качество водопроводной воды для питья постоянно контролируется органами санитарного надзора. Одна из проб ─ проба на окисляемость. Окисляемость воды перманганатом калия ─ условный показатель, характеризующий содержание в ней восстановителей, таких, как соли железа (II) соли серной и азотной кислот, органических кислот и других биологических соединений.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь экспериментально определять и рассчитывать концентрацию растворимых веществ в растворе методом перманганатометрии.
40
