
КНИЖЕЧКАметод_указ_мед_химия
.pdf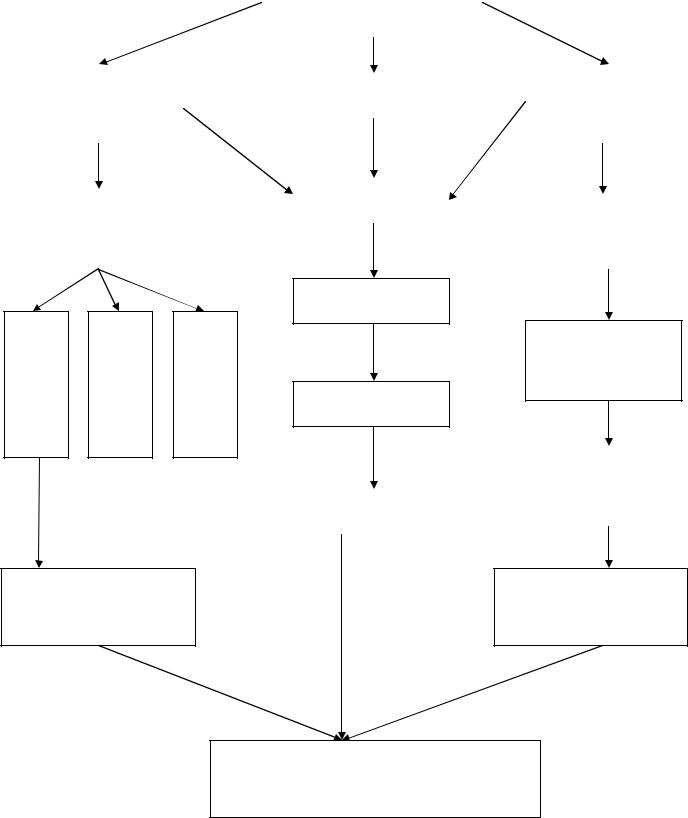
|
2.ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ. |
|
||||
|
|
|
|
|
|
|
|
|
ПОВЕРХНОСТНЫЕ |
|
|
||
|
|
|
ЯВЛЕНИЯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Свободная |
|
|
|
|
|
Поверхностное |
|
|
Адсорбтив |
|
|
||
поверхностная |
|
|
|
|
||
|
|
|
|
|
натяжение |
|
энергия |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Адсорбция |
|
|
Энергия Гиббса, |
|
|
Поверхностно- |
|
|
|
|
||
изотерма |
|
|
|
активные |
|
||||
адсорбции |
|
|
|
вещества |
|
|
|
|
|
Абсорбция
Адсорбция из растворов |
Молекулярная адсорбция |
Ионная адсорбция |
Адсорбционная
терапия (гемосорбция)
Поверхностноинктивные
вещества
Хемосорбция
|
|
Строение |
|
|
молекул ПАВ и |
Адсорбент |
|
ПИВ |
|
|
|
|
|
|
Применение ПАВ в медицине
Медико-биологическая роль сорбционных процессов
101
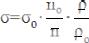
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 562-593.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 217-242.
Дополнительная литература.
3.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 166-182.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 153-167.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1. Определение поверхностного натяжения этилового спирта сталагмометрическим методом.
Принцип метода: метод основан на определении массы капли, вытекающей из сталагмометра, в момент ее отрыва.
Материальное обеспечение: сталагмометр, этиловый спирт различных концентраций: 0,1М, 0,25М, 0,5М, 0,75М, дистиллированная вода, стеклограф, пробирки, груша, фильтровальная бумага.
Ход работы:
1.Поставьте стеклографом граничные метки на сталагмометре.
2.Сталагмометр заполните водой до верхней метки.
3.Дайте воде вытекать из капилляра по каплям.
4.Считайте капли от верхней до нижней метки.
5.Опыт повторите трижды.
6.Рассчитайте среднее значение числа капель (nо).
7.Повторите пункты 2-6 для водных растворов этилового спирта различных концентраций.
8.Экспериментальные данные внесите в таблицу,
Исследуемые |
Число капель |
Среднее |
Поверхностное |
||
растворы |
1. |
2. |
3. |
значение |
натяжение |
Вода |
|
|
|
|
|
C2H5OH 0,1М |
|
|
|
|
|
C2H5OH 0,25М |
|
|
|
|
|
C2H5OH 0,5М |
|
|
|
|
|
C2H5OH 0,75М |
|
|
|
|
|
9. Рассчитайте поверхностное натяжение растворов спирта σ по формуле:
где σo – поверхностное натяжение воды = 7,3·10-2дж/м2;
102
no и ρo – плотность и число капель воды; n и ρ – плотность и число капель спирта;
ρ и ρв – принимаем приблизительно равными 1 г/см3.
10.Постройте график зависимости: σ = f(С) при Т = const.
11.Оформите протокол лабораторной работы
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Из термодинамики известно, что всякая система стремиться обладать минимальным запасом энергии. Укажите, каким путем можно уменьшить свободную поверхностную энергию гетерогенной системы.
A.Уменьшить поверхностное натяжение;
B.Уменьшить концентрацию растворенных веществ;
C.Увеличить поверхность раздела фаз;
D.Увеличить поверхностное натяжение;
E.Прокипятить раствор.
Задание 2.
Поверхностно-активными свойствами обладают многие органические соединения. Укажите, какое из указанных соединений имеет наиболее высокую поверхностную активность.
A.Трилон-Б;
B.Стеариновая кислота;
C.Бутанол;
D.Уксусная кислота;
E.Фосфорная кислота.
Задание 3.
Поверхностно-активные вещества обычно обладают низким поверхностным натяжением. Укажите характерную особенность строения молекул ПАВ.
A.Дифильность;
B.Малое сродство к воде;
C.Хорошая растворимость в воде;
D.Отрицательная адсорбция;
E.Наличие двух ковалентных связей.
Задание 4.
Среди процессов происходящих на поверхности раздела фаз в гетерогенных системах большое значение имеют сорбционные явления. Укажите название вещества, являющееся поглотителем.
A.Сорбент;
B.Сорбтив;
C.Адсорбтив;
D.Абсорбтив;
103
E. Десорбция.
Задание 5.
Всякая поверхность характеризуется запасом энергии, называемой поверхностной энергией. Укажите, от какого фактора зависит эта энергия.
A.природы растворителя;
B.природы растворенного вещества;
C.величины площади раздела фаз;
D.величины поверхностного натяжения;
E.диэлектрической проницаемости.
Задание 6.
Адсорбция – это изменение концентрации компонентов в поверхностном слое по сравнению с объемной фазой. Укажите, что происходит при адсорбции на границе раздела фаз.
A.установление адсорбционного равновесия между неподвижной и подвижной фазами;
B.удаление адсорбированных веществ с адсорбентов при помощи растворителей;
C.накопление одного вещества на поверхности другого;
D.взаимодействие адсорбента и адсорбтива;
E.поглощаемое вещество диффундирует вглубь поглотителя и распределяется по всему объему.
Задание 7.
Чем больше радиус иона, тем выше его поляризуемость и тем лучше ионы адсорбируются. Укажите ион, обладающий наибольшей адсорбционной способностью.
A.Na+;
B.Cs+;
C.K+;
D.Ca2+;
E.Al3+.
Задание 8.
Поверхностно-инактивные вещества хорошо растворимы в воде и взаимодействие их с растворителем сильнее, чем между молекулами растворителя. Укажите поверхностно-инактивное вещество.
A.Пропановая кислота;
B.Метиламин;
C.Уксусная кислота;
D.Бутанол;
E.Серная кислота.
104
Задание 9.
Процесс очистки воды при помощи ионитов широко используется в промышленности. Укажите, от каких ионов можно очистить воду при помощи анионитов.
A.Ca2+;
B.Na+;
C.H3O+;
D.HNO2;
E.Cl-.
Эталоны ответов. |
|
|
|
|
1 |
– A; |
5 |
– C; |
9 – E. |
2 |
– B; |
6 |
– C; |
|
3 |
– A; |
7 |
– E; |
|
4 |
– A; |
8 |
– Е; |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
Вначале занятия осуществляется определение уровня подготовки студентов
кзанятию при помощи фронтальной беседы.
Следующим этапом является выполнение лабораторной работы с использованием приведенной инструкции. После завершения практической части, студенты оформляют протокол, в который вносят уравнения проведенных реакций и наблюдаемые при проведении опытов аналитические сигналы.
После выполнения лабораторной работы, студенты выполняют самостоятельную работу путем решения ситуационных задач по теме: «Сорбция биологически-активных веществ на границе раздела фаз. Адсорбция на поверхности жидкости».
Далее происходит анализ и коррекция знаний студентов путем рассмотрения теоретических вопросов решения обучающих задач.
Следующим этапом проводится тестовый контроль знаний студентов по теме: «Сорбция биологически-активных веществ на границе раздела фаз. Адсорбция на поверхности жидкости» с использованием тестов формата А.
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля и осуществляется проверка протоколов выполненной лабораторной работы.
105
ДИСПЕРСНЫЕ СИСТЕМЫ. ПОЛУЧЕНИЕ, ОЧИСТКА И СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Окружающий мир – растительные и животные организмы, объекты неживой природы, продукты питания и т.д. – это дисперсные системы разной степени организации. Изучение свойств и закономерностей процессов, характерных для дисперсных систем, дает возможность познавать саму жизнь. Коллоидное, надмолекулярное и высокомолекулярное состояние организации материи реализуется в процессе эволюции всего живого.
Белки – основа существования живой материи в клетках живых организмов находятся в виде коллоидно-дисперсных систем. Отдельная клетка – это сложная дисперсная система, в которой определенные вещества – минеральные и органические (белки, нуклеиновые кислоты, моно-, ди-, полисахариды, липиды, витамины, гормоны) – с разной степенью дисперсности формируют цито – и кариоплазму, а также органеллы и включения. Среди биологических объектов с разными размерами частичек к дисперсным системам можно отнести: эритроциты крови человека, клиническую палочку, вирус гриппа. Размеры частичек в этих системах отличаются на несколько порядков
Коллоидные системы присутствуют в крови, лимфе спинномозговой жидкости. В коллоидном состоянии находятся также соли кальция, магния, силикаты, жиры, фосфаты, а также холестерин и другие малорастворимые вещества, которые присутствуют в биологических системах.
Электрокинетическое явление такое как электрофорез широко применяется в медицине для разделения и анализа белков, для разделения смесей аминокислоты, антибиотиков, ферментов, антител, форменных элементов крови, бактериальных клеток, для определения чистоты белковых препаратов. С помощью электрофореза осуществляет транспорт лекарственных препаратов через кожу. Введение лекарственных препаратов через кожу создает депо, которое продолжительное время влияет на организм больного человека электрофорез используют в фармацевтической промышленности для очистки различных лекарственных препаратов. Для очистки лекарственных сывороток используют электроосмос.
Диализ используют для очистки растворов белков (ферментов) от примесей низкомолекулярных соединений. По принципу компенсационного диализа работает аппарат «искусственная почка».
Исследование оптических свойств дисперсий имеет большое значение для изучения их структуры, определения концентрации, размеров и формы частичек.
Знания физико – химических свойств коллоидных систем необходимо для изучения последующих дисциплин: биохимии, фармакологии, физиологии, терапии, а также в практической деятельности врача.
106
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь идентифицировать явления диализа, ультрафильтрации, компенсационного и вивидиализа, как основы понятия физико – химических процессов, которые происходят в коллоидных системах для изучения биологии и медицины.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Идентифицировать понятие «дисперсные системы» и их классификацию.
2.Интерпретировать методы получения дисперсных систем.
3.Идентифицировать методы очистки коллоидных систем.
4.Интерпретировать молекулярно-кинетические и оптические свойства коллоидных систем.
5.Интерпретировать понятия: аэрозоли, эмульсии, суспензии.
6.Трактовать роль дисперсных систем в биологии и медицине.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Дисперсные системы, их классификация по степени дисперсности. Лиофильные и лиофобные коллоидные системы.
2.Методы получения коллоидных систем.
3.Методы очистки коллоидных систем. Вивидиализ. Гемодиализ и аппарат «искусственная почка».
4.Свойства дисперсных систем:
−молекулярно – кинетические (броуновское движение, диффузия, осмотическое давление, седиментация);
−оптические (опалесценция, уравнение Релея, конус Тиндаля).
5.Аэрозоли, суспензии и пасты. Методы их получения и свойства, медицинское использование.
6.Эмульсии, методы получения и свойства. Типы эмульсий. Эмульгаторы. Применение эмульсий в клинической практике. Биологическая роль эмульсий и суспензии.
107
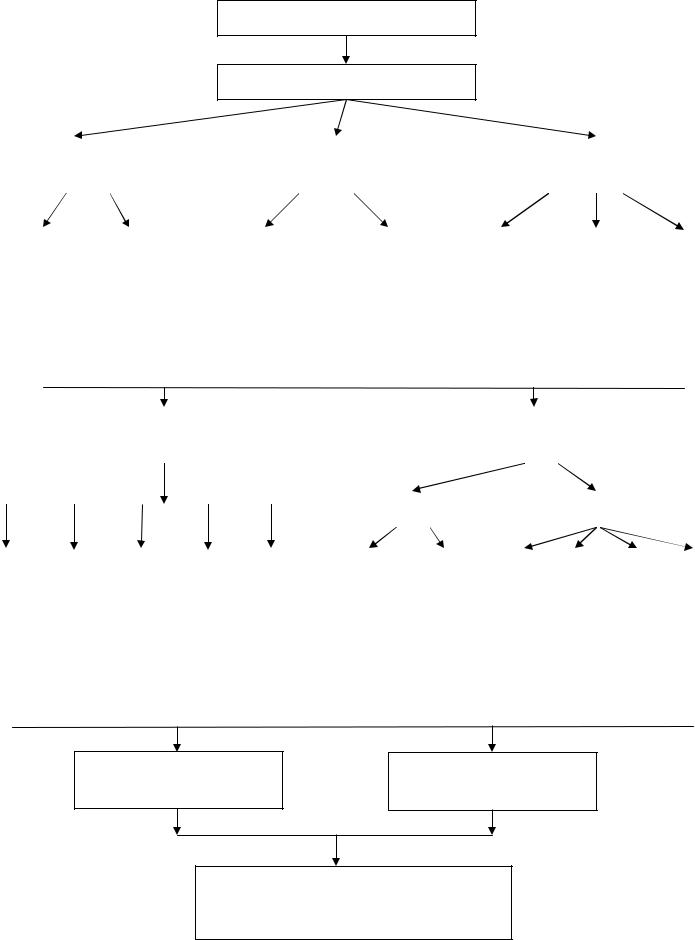
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
ДИСПЕРСНЫЕ СИСТЕМЫ
Классификация
по агрегатному |
|
по межфазному |
|
по степени |
состоянию |
|
взаимодействию |
|
дисперсности |
|
|
|
|
|
Дисперсная фаза |
|
Дисперсионаая среда |
|
лиофильные |
|
лиофобные |
|
высокодисперсные |
|
среднедисперсные |
|
грубодисперсные |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МЕТОДЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
МЕТОДЫ |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
ОЧИСТКИ |
|
|
|
|
|
|
|
|
|
|
|
|
ПОЛУЧЕНИЯ |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конденсация |
|
|
|
диспергирование |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диализ |
|
Электродиализ |
|
|
Компенсационный диализ |
|
Вивидиализ |
|
|
Ультрафиьтраци |
|
|
Физическая |
|
Химическая |
|
|
|
Пептизация |
|
Мельницы |
|
Ультразвук |
|
|
Электричество |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молекулярно- |
Оптические свойства |
кинетические свойства
Применение эмульсий, суспензий, аэрозолей, порошков, паст в медицине
108
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 603-615; 618-641; 730-740; 749-758.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 252-267; 304-311.
Дополнительная литература.
3.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 187-210.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 132-152.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Опыт №1. Получение реакцией гидролиза золя гидроксида железа (III).
Принцип метода: основан на химической конденсации.
Материальное обеспечение: колба, горелка, дистиллированная вода, пипетка, раствор хлорида железа (III) (2%), цилиндр.
Ход работы:
1.В термостойкую колбу внесите 50 мл дистиллированной воды.
2.Нагрейте воду до 80-900 С.
3.Быстро по каплям, прилейте 10 мл 2% хлорида железа (III)
4.Наблюдайте окраску золя
5.Напишите уравнение реакции получения золя железа (III)
6.Определите тип реакции метода химической конденсации.
Опыт №2. Получение золя канифоли.
Принцип метода: метод основан на применении физической конденсации. Материальное обеспечение: колба, горелка, дистиллированная вода,
пипетка, цилиндр, воронка, бумажный фильтр, стаканчик, пробирка. Ход работы:
1.В термостойкую колбу внесите 20 мл воды.
2.Нагрейте воду до появления пара.
3.Влейте в колбу 1 мл 1% спиртового раствора канифоли.
4.Наблюдайте образование золя.
5.Вложите бумажный фильтр в воронку и профильтруйте золь от примесей грубодисперсных частиц.
6.Пробирку с золем поместите на пути луча света.
7.Наблюдайте конус Тиндаля.
8.Укажите метод и тип реакции получения золя.
Опыт №3. Получение гидрозоля серы.
Принцип метода: метод основан на применении метода химической конденсации.
109
Материальное обеспечение: колба, пипетка, раствор тиосульфата натрия 0,05 М, фосфорная кислота разбавленная.
Ход работы:
1.В колбу поместите 10 мл. раствора тиосульфата натрия 0,05 М
2.Добавьте 3-4 мл разбавленной фосфорной кислоты
3.Напишите уравнение реакции образования гидрозоля серы
4.Колбу с раствором оставьте на 20-30 мин.
5.Наблюдайте изменение окраски полученного золя
Опыт №4. Получение гидрозоля сернокислого бария.
Принцип метода: метод основан на применении метода химической конденсации.
Материальное обеспечение: пробирка, раствор серной кислоты, раствор хлорида бария (2%)
1.В пробирку поместите 2 мл серной кислоты.
2.Добавьте 1-2 капли раствора хлорида бария.
3.Наблюдайте цвет образовавшегося золя.
4.Напишите уравнение реакции.
Опыт №5. Пептизация осадка (Fe(OH)3) гидроксида железа (III) раствором FeCl3.
Принцип метода: метод основан на применении метода пептизации. Материальное обеспечение: колба, воронка, фильтровальная бумага,
раствор хлорида железа (10%) пипетка, раствор аммиака (5%) дистиллированная вода.
Ход работы:
1.В колбу поместите 30 мл дистиллированной воды.
2.Добавьте 1 мл 10% раствора хлорида железа (III).
3.К полученному раствору добавьте каплями раствор аммиака (5%).
4.Наблюдайте появление хлопьев в растворе.
5.Добавьте еще немного аммиака, если жидкость над осадком окрашена.
6.Напишите уравнение реакции.
7.Наблюдайте выпадение осадка.
8.В воронку поместите фильтровальную бумагу и отфильтруйте осадок.
9.Осадок на фильтре обработайте раствором хлорида железа (III).
10.Наблюдайте фильтрацию золя гидроксида железа (III).
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Большинство биологических водных растворов представляют собой системы, в которых одно вещество, находящееся в раздробленном виде, равномерно распределено в общей массе другого. Дайте название данному понятию.
A. Дисперсная фаза;
110
