
КНИЖЕЧКАметод_указ_мед_химия
.pdfОпыт №2.
Получение комплексных соединений обменными реакциями.
Принцип метода: метод основан на взаимодействии гексацианоферрата (II) калия (желтой кровяной соли) с солями железа (III) с образованием в кислой среде синего осадка берлинской лазури.
Материальное обеспечение: пробирки, раствор хлорида железа (III), раствор гексацианоферрата (II) калия (желтой кровяной соли) K4[Fe(CN)6], 0,1М раствор соляной кислоты HCl.
Ход работы:
1.В пробирку внести 4 капли раствора хлорида железа (III).
2.Добавить 4 капли раствора (желтой кровяной соли) K4[Fe(CN)6].
3.Внести 2-3 капли 0,1М раствора соляной кислоты HCl.
4.Наблюдать образование синего осадка берлинской лазури, который необходимо сохранить для следующего опыта.
5.Составить уравнение реакции.
Опыт №3.
Разрушение осадка берлинской лазури.
Принцип метода: метод основан на реакции взаимодействия едкой щелочи и осадка берлинской лазури, которая сопровождается разрушением комплекса и изменением окраски раствора.
Материальное обеспечение: пробирка с осадком берлинской лазури, раствор едкого калия КОН.
Ход работы:
1.К осадку берлинской лазури добавить 5-6 капель раствора едкого калия
КОН.
2.Наблюдать изменение цвета осадка.
3.Составить уравнение реакции в молекулярном и ионном виде.
4.Сделать вывод относительно действия щелочей на осадок берлинской лазури.
Опыт №4.
Определение общей жесткости воды методом комплексонометрии.
Принцип метода: метод основан на способности трилона Б образовывать хелатные комплексы с ионами Са2+ и Mg2+, присутствующими в воде.
Материальное обеспечение: мензурка, мерные пробирки, конические колбы для титрования, штатив, бюретка, воронка, аммонийная буферная смесь, сухой индикатор, 0.01М раствор трилона Б, водопроводная вода.
Ход работы:
1.В колбу для титрования отмерить 25 мл исследуемой воды с помощью мензурки.
2.Внести 2 мл аммонийной буферной смеси и стеклянную ложечку сухого индикатора.
3.Бюретку заполнить 0.01М раствором трилона Б до нулевой отметки по нижнему мениску.
51

4.Титровать раствором трилоном Б исследуемую смесь до изменения окраски раствора от вино-красного до синего.
5.Повторить титрование 3 раза и рассчитать средний объём трилона Б израсходованного на титрование.
6.Общую жесткость воды рассчитать по формуле:
где Vтрилона Б – средний объем трилона Б, израсходованного на титрование, мл; СЭ трилона Б – нормальная концентрация раствора трилона Б, моль∙экв/л; 



 – объём исследуемой воды, мл.
– объём исследуемой воды, мл.
7. Сравнить полученное значение жесткости воды с нормативными показателями общей жесткости водопроводной воды, сделать вывод.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Координационное число – важная характеристика комплексного соединения. Определите это число в соединении K3[Fe (C2O4)3].
A.2;
B.3;
C.6;
D.5;
E.1.
Задание 2.
Устойчивость комплексного соединения [Zn(NH3)4](OH)2 характеризуется константами нестойкости. Выберите выражение этой константы по первой ступени.
A.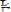




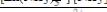 ;
;
B.





 ;
;
C.




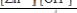 ;
;
D.





 ;
;
E. 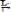




 .
.
52
Задание 3.
Комплексный ион [Co(CN)6]4– в растворе диссоциирует ступенчато. Определите заряд центрального атома при полной диссоциации комплексного иона.
A.+3;
B.0;
C.+2;
D.–2;
E.–3.
Задание 4.
Ионы тяжелых металлов (Hg+2, Ag+, Cu+2 и другие) в больших концентрациях блокируют работу ферментов. Объясните с химической точки зрения действие этих ионов.
A.Взаимодействуют с аминогруппами;
B.Блокируют пептидные связи;
C.Взаимодействуют с SH – группами;
D.Изменяют первичную структуру белков;
E.Взаимодействуют с концевыми карбоксильными группами белков.
Задание 5.
В качестве антидота при отравлении солями тяжелых металлов применяют динатриевую соль этилендиаминтетрауксусной кислоты (трилон Б):
NaOOC |
CH2 |
CH2 |
COONa |
||
|
N |
|
CH2 CH2 |
N |
|
|
|
|
|||
HOOC |
CH |
CH2 |
COOH |
||
|
2 |
|
|
|
|
Укажите дентантность этого лиганда.
A.6;
B.3;
C.4;
D.5;
E.1.
Задание 6.
При кипячении воды на дне чайника образовался осадок солей. Определите характер образовавшегося осадка.
A.Ca(HCO3)2 + Mg(HCO3)2;
B.CaCO3 + MgCO3;
C.CaCl2 + MgCl2;
D.Na2SO4 + K2SO4;
E.NaCl + KCl.
53
Задание 7.
В санитарно-гигиенической лаборатории определили, что общая жесткость воды равна 10 мг∙экв/л. Укажите степень жесткости данной воды.
A.Мягкая;
B.Средней жесткости;
C.Жесткая;
D.Очень жесткая;
E.Дистиллированная.
Эталоны ответов.
1 |
– C; |
5 |
– C; |
2 |
– A; |
6 |
– A; |
3 |
– C; |
7 |
– C. |
4 |
– C; |
|
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия осуществляется проверка подготовки студентов к самостоятельной работе путем фронтальной беседы. Студенты решают учебные задания, разбирают и закрепляют теоретический материал: интерпретируют строение комплексных соединений в соответствии с основными положениями координационной теории Вернера.
После решения обучающих заданий студенты приступают к выполнению самостоятельной работы. Используя инструкцию к лабораторно-практическому занятию, они выполняют лабораторную работу. После окончания ее студенты оформляют протокол лабораторной работы. В протокол записываются уравнения проведенных реакций и внешние эффекты, которые сопровождали данные опыты, рассчитывается общая жесткость водопроводной воды.
После завершения лабораторной работы осуществляется анализ и коррекция знаний студентов путем рассмотрения образования, диссоциации, устойчивости комплексных соединений, структуры полидентантных лигандов, понятия жесткости воды, а также медико-биологического значения комплексонов.
Следующим этапом является проведение тестового контроля знаний студентов то теме «Комплексообразование в биологических системах» с использованием тестов формата А.
Занятие заканчивается подведением итогов работы и оценкой знаний студентов: озвучиваются результаты тестового контроля и осуществляется проверка протоколов выполненной лабораторной работы.
54
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ В ОРГАНИЗМЕ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Все физиологические жидкости организма (желудочный сок, плазма крови, внеклеточная, внутриклеточная и спинномозговая жидкости) представляют собой водные растворы. Компонентами данных систем является катионы и анионы сильных электролитов (K+; Na+; Mg2+; HPO42-; H2PO4-; HCO3-; Cl-), а также органические соединения (глюкоза, полисахариды, белки и др.), являющихся слабыми электролитами. Важными функциями электролитов организма являются: поддержание осмотического давления и значения ионной силы биологических жидкостей, влияние на биоэлектрические потенциалы, свертывание крови и др.
Особенную физиологическую активность проявляют ионы водорода и гидроксид-ионы, которые определяют кислотность внутренних сред организма, влияют на активность ферментов и др. Кислотность биологических жидкостей, количественной характеристикой которой является водородный показатель – рН, является одной из основных физико-химических характеристик жидкостных сред организма, определение которой позволяет сделать вывод относительно физиологического и патологического функционирования организма.
Таким образом, важным этапом в понимании многих физиологических явлений является рассмотрение свойств растворов электролитов и кислотноосновного состояния биологических жидкостей, которые позволяют объяснить механизм поддержания водно-солевого баланса и определить нарушения работы различных систем организма на стадии диагностики заболевания.
ЦЕЛИ ОБУЧЕНИЯ.
ОБЩАЯ ЦЕЛЬ.
Уметь трактовать свойства растворов электролитов и кислотно-основное равновесие биологических систем организма.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать понятия слабых и сильных электролитов.
2.Интерпретировать свойства растворов электролитов.
3.Интерпретировать теории кислот и оснований Аррениуса, БренстедаЛоури и Льюиса.
4.Интерпретировать диссоциацию воды и водородный показатель.
5.Трактовать теорию кислотно-основных индикаторов.
6.Трактовать водно-электролитное состояние и рН биологических систем организма.
55
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ.
1.Растворы электролитов. Электролиты в организме человека.
2.Степень и константа диссоциации слабых электролитов. Закон разведения Оствальда.
3.Свойства растворов сильных электролитов. Активность, ионная сила растворов сильных электролитов.
4.Теории кислот и оснований Аррениуса, Бренстеда-Лоури, Льюиса.
5.Диссоциация воды. Ионное произведение воды. Водородный показатель
рН.
6.Кислотно-основное титрование. Теория кислотно-основных индикаторов.
7.Водно-электролитный баланс организма. Значение рН биологических жидкостей.
56
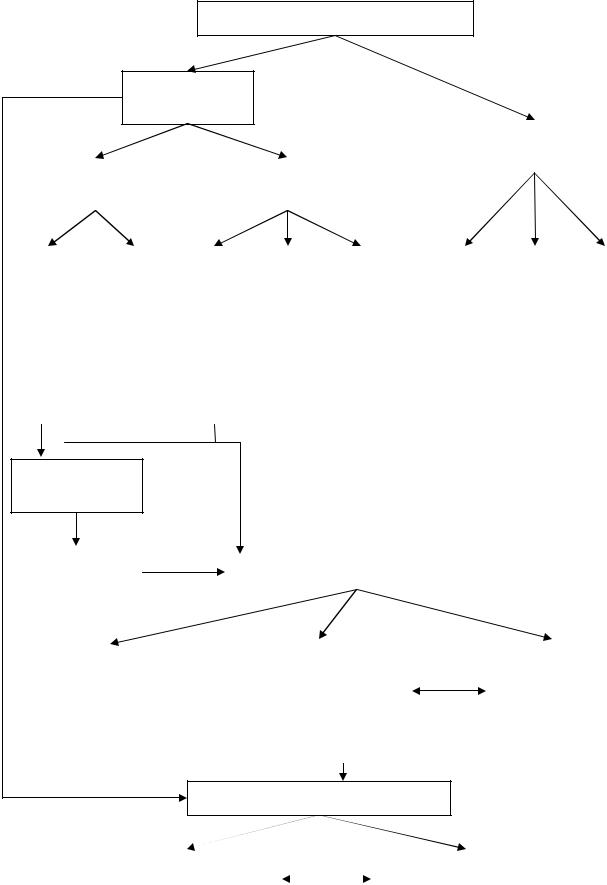
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
Кислотно-основное равновесие
Растворы
электролитов
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теории кислот и |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оснований |
|
|
||
|
|
Слабые |
|
|
|
|
Сильные |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
электролиты |
|
|
|
|
электролиты |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Диссоциация, К |
|
|
Степеньдиссоциа- ,законцииОстваьда |
|
|
Диссоциация |
|
|
Активность |
|
Ионнаясила |
|
АррениусаТеория |
|
БренстедаТеория - Лоури |
|
ТеорияЛьюиса |
|
||
|
Д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диссоциация
води
Ионное |
|
|
|
Водородный показатель |
|
произведение |
|
|
|
|
|
|
|
|
|
|
|
Экспериментальное |
|
Кислотно- |
||
Значения рН |
|
|
|||||
биологических |
|
определение |
|
основные |
|||
жидкостей |
|
(кислотно-основное |
|
индикаторы |
|||
|
|
|
титрование) |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Биологическая роль
водно-солевой |
|
кислотно-основное |
баланс |
|
равновесие |
|
|
|
57
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература.
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 129-151, 175-176.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 141-159.
Дополнительная литература.
3.Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 59-71, 75-77.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 77-87.
5.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія.
Підручник. – Вінниця: Нова книга, 2003. – С. 176-192, 195-196.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к проведению опытов на лабораторно-практической части занятия.
Вариант 1.
Определение концентрации кислоты титриметрическим методом (алкалиметрия).
Принцип метода: метод основан на экспериментальном определении концентрации раствора соляной кислоты методом кислотно-основного титрования.
Материальное обеспечение: колбы для титрования, пипетки мерные, груша, цилиндр, бюретка, фильтровальная бумага; раствор соляной кислоты с неизвестной концентрацией, раствор натрия гидроксида с молярной концентрацией 0,01моль/л, дистиллированная вода, раствор индикатора метилового красного.
Ход работы:
1.При помощи мерной пипетки отмерить раствор соляной кислоты неизвестной концентрации и поместить в колбу для титрования.
2.Отмерить цилиндром приблизительно 10 мл дистиллированной воды и добавить к раствору кислоты.
3.Добавить к полученному раствору 2-3 капли раствора индикатора метилового красного.
4.Наблюдать появление розового окрашивания.
5.Промыть бюретку дистиллированной водой, а затем небольшим количеством раствора щелочи (3 раза).
6.Заполнить бюретку раствором NaOH с молярной концентрацией 0,01моль/л и довести уровень жидкости до нулевого значения.
7.По каплям, при интенсивном перемешивании, к раствору HCl добавлять раствор щелочи до изменения окрашивания (ярко-желтое).
8.Определить объем раствора NaOH, который был использован для титрования.
58
9.Используя пункты 1-4 и 6-8, повторить эксперимент еще два раза.
10.Полученные результаты занести в таблицу:
№ |
VHCl, мл |
СNaOH, М |
VNaOH, мл |
1. |
|
0,01 |
|
2. |
|
0,01 |
|
3. |
|
0,01 |
|
cреднее |
|
0,01 |
|
значение |
|
|
|
|
|
|
|
СHCl, М |
|
рН |
|
11.Провести расчет концентрации соляной кислоты и величины рН данного раствора. Результаты занести в таблицу.
12.Сделать вывод относительно выбора индикатора (метилового красного) для алкалиметрического титрования.
Вариант 2.
Определение концентрации щелочи титриметрическим методом (ацидиметрия).
Принцип метода: метод основан на экспериментальном определения концентрации раствора натрия гидроксида методом кислотно-основного титрования.
Материальное обеспечение: колбы для титрования, пипетки мерные, груша, цилиндр, бюретка, фильтровальная бумага; раствор натрия гидроксида с неизвестной концентрацией, раствор соляной кислоты с молярной концентрацией 0,01моль/л, дистиллированная вода, раствор индикатора фенолфталеина.
Ход работы:
1.При помощи мерной пипетки отмерить раствор натрия гидроксида неизвестной концентрации и поместить в колбу для титрования.
2.Отмерить цилиндром примерно 10 мл дистиллированной воды и добавить к раствору щелочи.
3.Добавить к полученному раствору 2-3 капли раствора индикатора фенолфталеина.
4.Наблюдать появление малинового окрашивания.
5.Промыть бюретку дистиллированной водой, а затем небольшим количеством раствора кислоты (3 раза).
6.Заполнить бюретку раствором HCl с молярной концентрацией 0,01моль/л и довести уровень жидкости до нулевого значения.
7.По каплям, при интенсивном перемешивании, к раствора NaOH добавлять раствор кислоты до исчезновения окрашивания.
8.Определить объем раствора HCl, который был использован для титрования.
9.Используя пункты 1-4 и 6-8, повторить эксперимент еще два раза.
10.Полученные результаты занести в таблицу:
59
№ |
VNaOH, мл |
СHCl, М |
VHCl, мл |
1. |
|
0,01 |
|
2. |
|
0,01 |
|
3. |
|
0,01 |
|
cреднее |
|
0,01 |
|
значение |
|
|
|
|
|
|
|
СNaOH, М |
|
рН |
|
11.Провести расчет концентрации щелочи и величины рН данного раствора. Результаты занести в таблицу.
12.Сделать вывод относительно выбора индикатора (фенолфталеина) для ацидиметрического титрования.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
При экспериментальном определении электролитного состава внутриклеточной жидкости, установлено содержание белков, которое составляет 4,7·10-2 моль/л. Определите тип данного электролита.
A.Сильный;
B.Средней силы;
C.Слабый;
D.Полиэлектролит;
E.Неэлектролит.
Задание 2.
Для проведения биохимических исследований, был приготовлен 0,01моль/л раствор молочной кислоты (КД=1,38·10-4). Определите степень диссоциации в процентах и концентрацию ионов Н+ в данном растворе в моль\л.
A.0,012 и 1,2·10-6;
B.0,12 и 1,2·10-5;
C.1,2 и 1,2·10-4;
D.12 и 1,2·10-3;
E.12 и 1,2·10-2.
Задание 3.
С целью моделирования физиологических процессов, которые происходят в плазме крови, необходимо приготовить раствор натрия хлорида с величиной ионной силы 0,15 моль/л. Укажите молярную концентрацию (моль/л), которую должен иметь данный раствор.
A.0,015;
B.0,03;
C.0,15;
60
