
- •7. ГАЛОГЕНИРОВАНИЕ
- •Атомы галогенов – F, Cl, Br и I – являются фармакофорными группами.
- •ArNH2 ArOH
- •Реагенты реакций галогенирования:
- •Механизм реакции
- •Взаимодействие ароматических соединений с галогенами в присутствии катализаторов можно представить следующим образом:
- •При действии хлористого сульфурила идет окислительно-
- •Вотсутствие катализаторов, способствующих образованию катиона хлора, но под влиянием ультрафиолетового излучения (специальные лампы
- •Хлорирование бензола
- •При наличии в ароматическом ядре электроноакцепторного заместителя региоселективность процесса увеличивается, так как
- •При хлорировании толуола образуется смесь приблизительно равных количеств о- и п-хлортолуолов с примесью
- •Хлорирование фенола
- •Хлорирование анилина
- •Хлорирование нафталина
- •Хлорирование антрахинона
- •7.2 Бромирование, йодирование
- •Бром является дефицитным сырьем. Улавливание выделяющегося в процессе реакции бромида водорода не является
- •противовирусный препарат теброфен
- •Алкилгалогениды
- •Галогенирование альдегидов, кетонов и кислот
- •Получение галоидокетонов
- •Галогенирование в боковую цепь
- •7.3 Получение фторорганических соединений
- •CF3CHClBr СН3OCF2CHCl2
- •жидкофазное фторирование фтором, разбавленным большим количеством инертного газа:
- •Для получения перфторированных углеводородов широко используют фторирование соединений при высокой температуре в парах
- •препараты фторхинолонового ряда
- •ПРОВЕДЕНИЕ
- •Испарение и осушка хлора
- •Аппараты хлорирования
- •Технологическая схема каталитического хлорирования бензола

7. ГАЛОГЕНИРОВАНИЕ
Область применения реакции. Хлорирование. Агенты хлорирования. Основные факторы хлорирования ароматических соединений. Механизм и кинетика процесса. Особенности галогенирования производных бензола, нафталина и антрахинона. Хлорирование толуола в ядро и в боковую цепь. Технология процесса.
Бромирование. Агенты. Прямое и косвенное бромирование. Особенности технологического оформления процесса.
Фторирование органических соединений. Современная практика и перспективы промышленного применения фторпроизводных
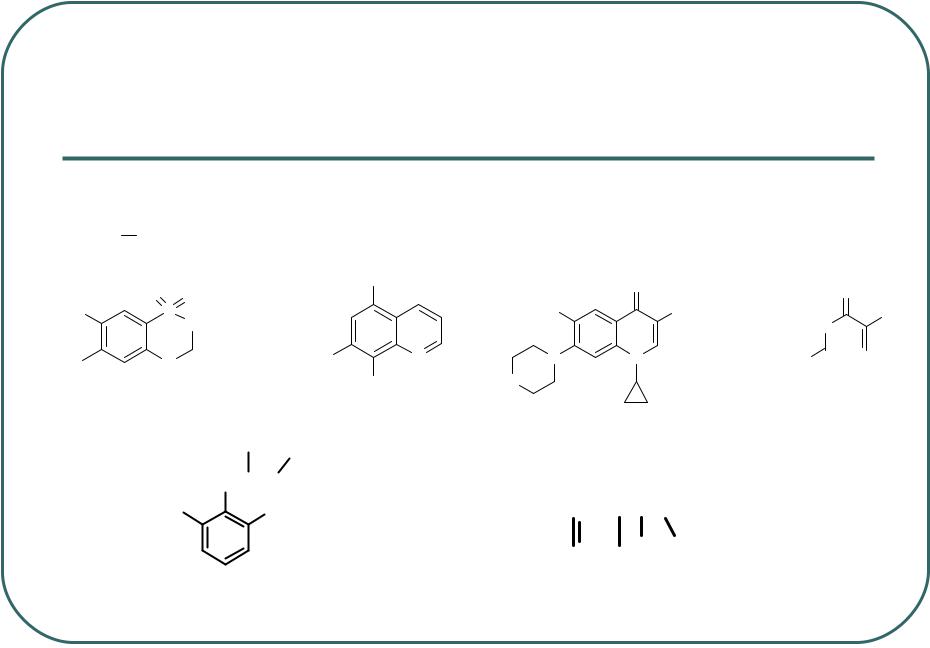
Атомы галогенов – F, Cl, Br и I – являются фармакофорными группами.
CHCl3
Cl3C CHO . H2O трихлорацетальдегид гидрат
|
O |
Cl |
|
|
O |
|
|
H2NO2S |
S |
|
|
|
|
NH |
|
Cl |
N |
I |
N |
|
H |
OH |
|
|
|
|
|
гидро хло ро тиазид |
ýí òåðî ñåï òî ë |
|
|
HN
HN
 N
N
Cl Cl
|
O |
F |
COOH |
N |
N |
HN
циф ран (цип ро ф ло ксацин ),
HO NHCOCHCl2 
 H
H
O2N
 H CH2OH
H CH2OH
Клонидин (клофелин), гипотензивный левомицитин
препарат
O
F
HN
O  N
N
H
ф то рурацил
ArNH2 ArOH
ArSH |
ArCN |
ArCl

Реагенты реакций галогенирования:
Cl2, Br2, I2 (но не F2) |
|
||
ClF, |
ICl |
|
|
HOCl, HOBr, ROCl, R-SO2NHCl, SO2Cl2, |
|||
HCl |
+ O2 |
CuCl2 |
Cl2 + H2O |
|
|||
|
|||
2 H2SO4 + 2 NaBr = Br2 + Na2SO4 + 2 H2O + SO2
Катализаторы: FeCl3, I2, H2SO4, NH4Cl, TiCl4, SbCl5

Механизм реакции
Реакционноспособная частица Hal+, как считалось ранее, образуется в результате следующих реакций:
FeCl |
|
+ Cl |
|
|
Cl+ + FeCl |
- |
3 |
2 |
|
4 |
|||
|
|
|
|
H SO |
|
+ Cl |
|
|
Cl+ + HCl + |
HSO |
- |
|||||||
4 |
|
4 |
||||||||||||
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
ãèï î |
ãàëî ãåí èòû |
H |
+ |
|
|
|
|
|
||||
HO-Cl + H+ |
|
|
|
|
|
O-Cl |
|
|
|
|
HOH + Cl+ |
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
H |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Однако при более подробном изучении было найдено, что действительным реагенто в хлорировании является оксид хлора Cl-O-Cl, который возникает по следующей реакции:
HO-Cl + Cl+  Cl-O-Cl + H+
Cl-O-Cl + H+
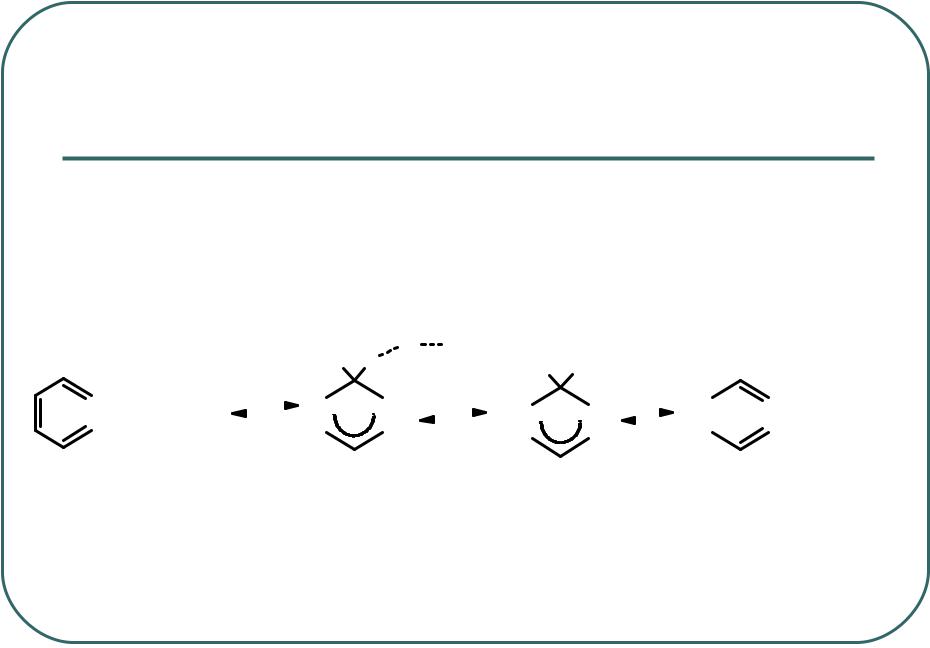
Взаимодействие ароматических соединений с галогенами в присутствии катализаторов можно представить следующим образом:
|
|
П о до бн ую п о ляризацию м о гут вы звать раство рители |
|||||||||||||||||||||||
с бо льш о й диэлектрическо й п о сто ян н о й: н итро бен зо л, |
|||||||||||||||||||||||||
Cl ---- Cl .......kat |
н итро м етан , ацето н итрил, уксусн ая кисло та ... |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
_ |
|
FeCl3 |
_ |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
Cl |
||||||||
|
+ Cl2 +FeCl3 |
|
|
|
|
H |
Cl |
|
|
|
|
|
H Cl |
FeCl4 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
+ HCl + FeCl3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гетеролитического разрыва связи между атомами хлора и брома с образованием ионов Cl+ и Br+ не происходит из-за высокой энергии активации этой реакции.
При действии хлористого сульфурила идет окислительно-
восстановительная реакция.
Реакция ускоряется в присутствии перекисей и при облучении ультрафиолетом.
Присоединение атома хлора к ароматическому ядру с образованием - комплекса идет по свободнорадикальному механизму.
H |
Cl |
_ |
Cl |
SO Cl |
|
||
|
|
2 |
|
+ SO2Cl2 |
+ |
|
+ HCl + SO2 |
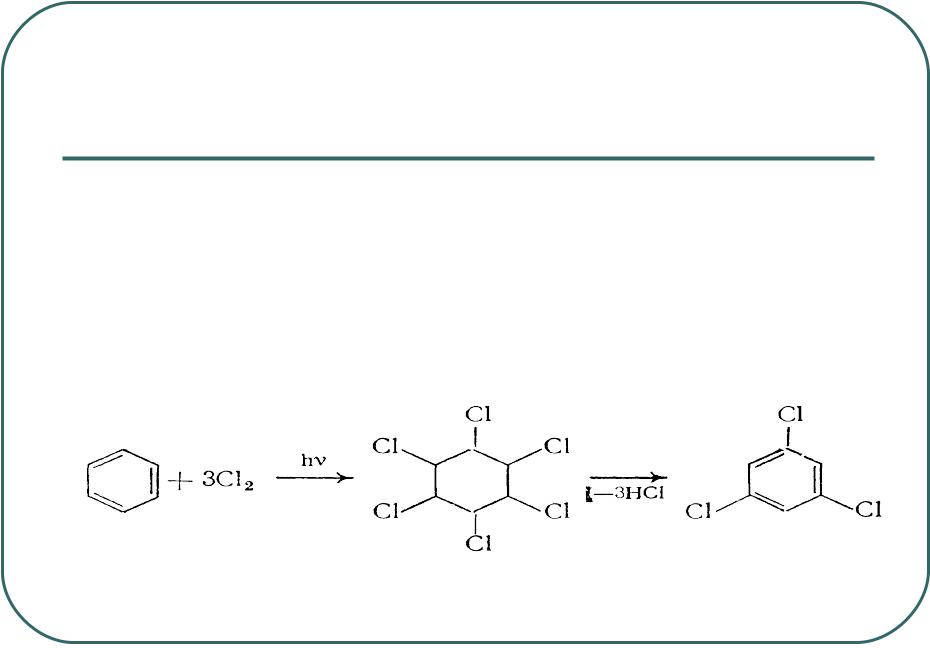
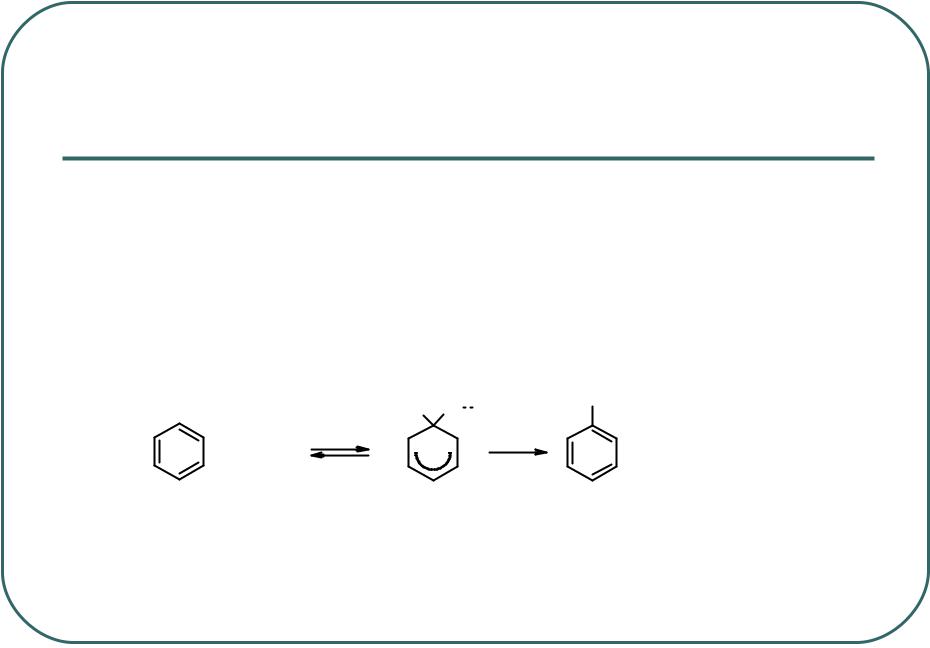
Вотсутствие катализаторов, способствующих образованию катиона хлора, но под влиянием ультрафиолетового излучения (специальные лампы или солнечный свет) незамещенные ароматические соединения способны присоединять хлор.
Вслучае бензола образуется гексахлорциклогексан, который
при нагревании теряет 3 молекулы хлористого водорода и превращается в трихлорбензол:

Хлорирование бензола
Cl2 |
Cl |
|
|
FeCl3 |
â 7 - 8 ðàç |
|
м едлен н ее |
П ро изво дство н еп реры вн о е
тем п ература 75 - 85 град.
со став реакц. м ассы н а вы хо де: 65% - бен зо л 34% - хло рбен зо л
1% - п о лихло ридо в
Cl |
Cl |
|
+ |
Cl |
Cl |
30% |
70% |
æ |
òâ |

Атом хлора обладает -I и +М эффектом.
За счет индуктивного эффекта снижается электронная плотность в бензольном ядре.
Но мезомерный эффект приводит к стабилизации -комплекса при о- и п-атаке электрофильного агента за счет дополнительной делокализации положительного заряда и, тем самым, к снижению свободной энергии активации
Cl |
H |
Cl + |
|
|
|
|
H |
|
|
|
|
+ |
Cl |
Cl |
|
|
|
Cl |
Cl |
Cl |
|
|
Cl |
|
Cl |
|
|
Cl |
|
|
|
|
|
||
|
|
|
|
|
Cl |
|
Cl |
Cl |
|
|
Cl |
|
Cl |
|
Cl |
|
Cl |
Cl |
|
|
Cl |
||
|
Cl |
|
Cl |
||
|
|
|
|||
|
Cl |
|
+ |
||
|
+ |
|
|
||
|
|
|
|
||
|
Cl |
Cl |
|
Cl |
Cl |
|
|
Cl |
|||
|
|
|
|
|
Трихлорбензолы вляются хорошими и пожаробезопасными высококипящими растворителями.
