
- •6. НИТРОВАНИЕ
- •Значение реакции
- •Реагенты для проведения реакции нитрования:
- •Кинетическое уравнение процесса
- •Условия реакции нитрования ароматических соединений
- •Региоселективность реакции нитрования п- хлортолуола
- •Нитрование бензолсульфокислоты
- •Нитрование производных анилина
- •При концентрации серной кислоты выше 80% анилин полностью протонирован и присутствует в растворе
- •Нитрование бензола
- •Нитрование толуола
- •Нитрование нафталина
- •Нитрование антрахинона
- •Проведение процесса нитрования
- •ОСНОВНЫЕ СПОСОБЫ НИТРОВАНИЯ
- •Схема аппарата для смешения (кислот)
- •Нитратор непрерывного действия.
- •Выделение нитропродуктов
- •ПРОИЗВОДСТВО НИТРОБЕНЗОЛА НЕПРЕРЫВНЫМ МЕТОДОМ
- •Контроль процесса
- •5. Нитрозирование
- •Если соединение содержит вторичную аминогруппу, то в первую

6. НИТРОВАНИЕ
Нитрование ароматических соединений. Нитрующие агенты, их влияние на механизм, кинетику и основные факторы процесса нитрования.. Особенности нитрования различных классов ароматических соединений (бензол, нафталин, антрахинон, ароматические сульфокислоты, амины и фенолы). Теоретический и прикладной аспекты. Методы контроля. Побочные реакции
Технология нитрования непрерывным и периодическим методами
Значение реакции
H
Ar-NO2  ArNH2
ArNH2
O-CH |
O-CH3 |
HO |
NHCOCHCl2 |
|
3 |
Cl |
|||
|
|
|||
Cl HNO3 |
|
H |
||
|
|
|||
O2N |
|
O N |
H CH2OH |
|
|
|
2 |
|
N |
|
|
|
|
N |
|
|
|
|
N |
|
|
|
левомицитин |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C N |
|
|
H3C N NO2 |
|
H3C N NO2 |
|
||||||||||||||||
|
|
|
|
|
H |
|
|
|
|
CH2CH2OH |
|
|||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
метронидазол

N |
|
|
|
|
N |
|
|
|
|
N |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C N |
|
|
H3C N NO2 |
|
H3C N NO2 |
||||||||||||||
|
|
|
|
|
H |
|
|
|
|
CH2CH2OH |
|||||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||
метронидазол
COOH |
|
COOH + |
|
|
|
|
|
|
|
|
|
|
|
|
O2N |
CH3 |
|
|
|
|
H N |
|
CH |
3 |
||
N |
CH3 |
Cl |
2 |
|
|
|
CH3 |
|
|
CH |
|
|
|
||||
H |
CH3 |
|
|
3 |
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
мефенаминовая кислота

Реагенты для проведения реакции нитрования:
1. Наиболее распространенный: HNO3 (63-65%, d 1.35 г/мл,) + H2SO4 (96%).
2. Для мало реакционноспособных соединений.
HNO3 (98%, d 1.5 г/мл) + H2SO4 (96%-100 %).
3. Для очень мало реакционноспособных соединений.
HNO3 (98%) + SO3 (4-63%), олеум.
4. Для получения полинитропроизводных: К(Na)NO3 или NH4NO3 + H2SO4 (96%).
5. Для реакционноспособных соединений, селективный реагент: HNO3 (98%, d 1.5 г/мл) + (CH3CO)2O (или СН3СООН
6. Для реакционноспособных соединений: Для реакционноспособных соединений. HNO3 (d 1,3 - 1,5). Осложнение
– побочная реакция окисления.

ArH + NO+2 |
|
|
|
ArH |
|
NO+2 |
|
K1 |
+ |
H |
K2 |
ArNO |
|
+ |
H + |
|
|
|
|
|
|
Ar |
2 |
||||||||||
|
|
|
|
|
|
|
NO2 |
|||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||
áûñò ðî |
-êî ì ï ëåêñ |
|
K-1 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO-NO2 + H + |
H2O + NO2+ |
|
|
H2O + H2SO4 |
H3O ++ HSO4- |
||
|
H2SO4 |
H + |
+ |
HSO4 |
- |
|
|
HNO3 + 2 H2SO4 |
NO2 |
+ |
+ |
H3O + + 2 HSO4 |
- |
||
В отличие от сульфирования реакция нитрования необратима. Опыты с дейтерированными соединениями показали, что медленной стадией является образование промежуточного комплекса. Распад же его протекает практически мгновенно. Таким образом, общая скорость процесса определяется первой его стадией.

Кинетическое уравнение процесса
Скорость реакции прямо зависит от концентрации азотной и серной кислот
K1[Ar-H][HNO3][H2SO4] 2
V=
[H2O][H+][HSO4-] 2

Условия реакции нитрования ароматических соединений
Заместитель |
Избыток |
HNO3 Состав нитрующей смеси, % |
|
Температура, 0С |
|
|
(моль) |
|
|
|
|
|
|
HNO3 |
H2SO4 |
H2O |
|
NHCOCH3 |
0 |
31 |
48 |
21 |
0 – 5 |
CH3 |
0 |
24 |
59 |
17 |
40 |
H |
0 |
20 |
65 |
15 |
40-60 |
Cl |
0 |
18 |
71 |
11 |
60-80 |
COOC2H5 |
0,1 |
18 |
75 |
7 |
80-95 |
NO2 |
0,1 |
18 |
80 |
2 |
90-100 |
1-CH3,2,4-ди-NO2 |
0,15 |
18 |
82 |
0 |
100-120 |
Региоселективность реакции нитрования п- хлортолуола
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
CH3 |
||
- 0,127 |
|
|
|
|
|
|
|
|
|
NO2 |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
- 0,117 |
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
Cl |
|
|
Cl |
|||||
Условия нитрования |
Выход 2-нитро-4-хлортолуола (%) |
Выход 3-нитро-4- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
хлортолуола (%) |
||
HNO3; SO3 |
55 |
|
|
|
45 |
||||||||||
H2SO4; HNO3 |
65 |
|
|
|
35 |
||||||||||
(CH3CO)2О; HNO3 |
87 |
|
|
|
13 |
||||||||||
По мере уменьшения концентрации катиона нитрония в реакционной массе региоселективность процесса увеличивается.
Нитрование в уксусном ангидриде дает в основном 2-нитро-4- хлортолуол.
Нитрование бензолсульфокислоты
SO3H |
|
SO3H |
NO2 |
SO3H |
NO2 |
|
HNO3 |
NO2 |
|
|
SO3, H2SO4 |
|
+ |
|
+ |
|
|
|
|
|
1200C |
||
|
|
|
|
|
|
|
|
15% |
|
80% |
NO2 |
|
|
5% |
|
||
|
|
|
|
|
SO3H |
|
SO3H |
|
|
|
NO2 |
|
HO3S |
NO2 |
|
|
|
|
|
|
|
||
|
|
+ |
|
|
NO2 |
Происходит ипсо-замещение и 1,2-сдвиг в σ-аддукте
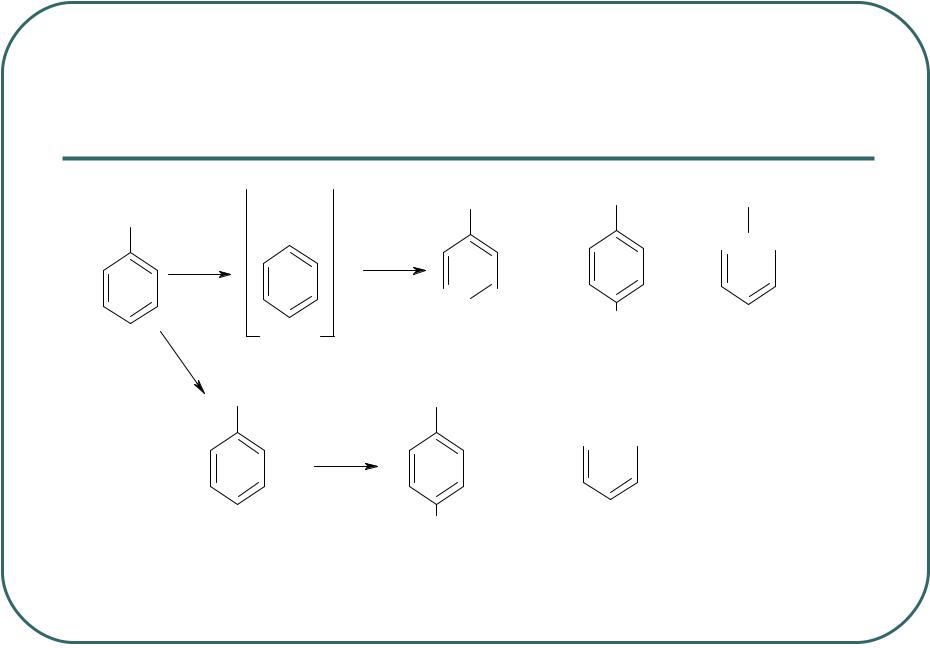
Нитрование производных анилина
NH |
|
|
+ NH |
|
|
HSO- |
NH2 |
|
|
|
|
|
|||||
2 |
|
|
|
3 |
3 |
|
||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+
 NO2 ~ 60%
NO2 ~ 60%
NHCOR NHCOR
+
NO2 90%
NH2 NH2
+ 
 NO2
NO2
NO2
NHCOR

 NO2
NO2
~ 5%
