
- •Методические указания
- •Содержание
- •1 Техника безопасного проведения работ химической лаборатории
- •2 Очистка и подготовка химической посуды
- •3 Техника выполнения основных операций
- •4 Общие указания к работе в лаборатории
- •5 Неорганическая химия (Качественный анализ)
- •Получение и собирание кислорода
- •5.2 Скорость химических реакций. Химическое равновесие
- •5.3 Электролитическая диссоциация
- •5.4 Произведение растворимости
- •5.5 Гидролиз солей
- •5.6 Карбонаты. Жесткость воды
- •5.7 Окислительно-восстановительные реакции
- •5.8 Комплексные соединения
- •5.9 Коррозия металлов
- •6. Аналитическая химия (Количественный анализ)
- •6.1 Определение металлов в растворе комплексонометрическим методом
- •6.3 Определение содержания щавелевой кислоты в растворе перманганатометрическим методом
- •6.6 Определение содержания кислот в растворе методом нейтрализации
- •7.2 Лабораторная работа №2
- •7.3 Лабораторная работа №3
- •8 Размерность
- •9.1 Расчеты массы навески вещества
- •9.2 Щелочи
- •9.3 Кислоты
- •Растворение серной кислоты в воде
- •9.4 Органические вещества
- •9.5 Различные смеси
- •10 Индикаторы
- •11 Демонстрационные опыты Синергетика – теория самоорганизации
- •11.1 «Жук бомбардир»
- •11.2 Реакция Бриггса-Раушера «Йодные часы»
- •11.3 Твёрдофазная колебательная реакция:
- •11.4 Реакция Белоусова-Жаботинского «Химический маятник»
- •11.5 «Фейерверк в жидкости»
- •11.6 Красные призмы.
- •11.7 «Живые капли ртути»
- •11.8 Получение оксалата железа.
- •11.9 "Замерзание" воды при комнатной температуре
- •11.10 Получение оксида хрома (III)
- •11.11 Реакция «Серебряного зеркала»
- •12 Регенерация химических остатков
- •12.1 Регенерация остатков серебра в нитрат серебра
- •12.2 Регенерация остатков серебра в гранулы
- •13 Упаковка и хранение токсичных веществ
- •Список некоторых веществ
- •14 Кристаллография
- •14.1 Кристаллы металлической меди
- •Подсказка
Получение и собирание кислорода
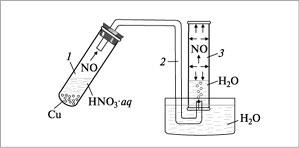
Получение оксида азота(II) и собирание его методом вытеснения воды

Получение хлора и его поглощение водой
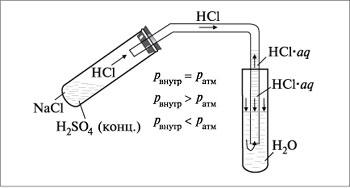
В таком приборе нельзя растворять газы HCl и NH3, а SO2 и Сl2 – можно
5.1 Классы неорганических соединений
|
Опыт №1 демонстрационный 1. Красный фосфор |
Опыт №2 1. ZnO 6. CuSO4 2. H2SO4 или HCl 7. AlCl3 3. NaOH или КOH 8. FeCl3 4. Спиртовка 9. H2SO4 5. ZnSO4 |
|
Опыт №3 1. CuSO4 5. Ca(OH)2 СУХОЙ 2. Гвоздь 6. CoCl2 3. Zn ГРАНУЛИРОВАННЫЙ 7. NaOH 4. HCl | |
5.2 Скорость химических реакций. Химическое равновесие
|
Опыт №1 1. Na2S2O3 2. H2O 3.Стеклянные стаканы по 3штуки 4. H2SO4 |
Опыт №2 1. H2O2 2.MnO2 3.Лучинка |
|
Опыт №3 1. HCl 2. CaCO3 МЕЛ В КУСОЧКАХ 3. CaCO3 МЕЛ В ПОРОШКЕ |
Опыт №4 1. K2CrO4 2. HCl
|
5.3 Электролитическая диссоциация
|
Опыт №1 1. CoCl2 СУХОЙ 2. Ацетон |
Опыт №2 1. Н3РО4 4. KSCN или NH4SCN 2. NaOH 5. AgNO3 3. FeCl3 |
|
Опыт №3 1. FeCl3 3. BaCl2 2. NaOH 4. H2SO4
|
Опыт №4 1. СН3СООNa 4. NaOH 2. NH4Cl 5. Na2CO3 СУХОЙ 3. HCl |
|
Опыт №5 1. СН3СООН 4. NH4OH 2. Метилорандж 5. Фенолфталеина 3. СН3СООNa СУХОЙ 6. NH4Cl СУХОЙ | |
5.4 Произведение растворимости
|
Опыт №1 1.FeSO4 2.Na2S 3.H2S |
Опыт №2 1.KCl 2. K2CrO4 3. AgNO3 |
|
Опыт №3 1. BaCl2 5. Pb(NO3)2 2.(NH4)2C2O4 6. NaCl 3.Фильтр 7. KJ 4. K2CrO4
|
Опыт №4 1. AgNO3 6. CaCl2 2. NaBr 7. (NH4)2C2O4 3. KJ 8. HCl 4. KCl 9. СН3СООH 5. NH4OH |
|
Опыт №5 1. Pb(NO3)2 3. NH4S 2.Na2SO4 4. K2CrO4 |
|
