
- •Кафедра химии
- •Содержание
- •Общие правила работы в лаборатории
- •Правила техники безопасности
- •Оказание первой помощи
- •Порядок оформления работ
- •Общая химия
- •Тема 1. Растворы
- •Работа 1. Приготовление рабочего 0,1n раствора hCl
- •Плотность растворов соляной кислоты
- •Работа 2. Определение нормальности рабочего раствора hCl по 0,1n раствору NaOh
- •Работа 3. Древовидные образования
- •Работа 4. Рост искусственной «клетки» Траубе
- •Тема 2. Гетерогенные равновесия и процессы
- •Работа 5. Определение хлоридов мочи по Мору
- •Тема 3. Комплексонометрия
- •Работа 6. Определение общей жесткости воды трилонометрическим методом.
- •Тема 4. Протолитические равновесия и процессы
- •Работа 7. Приготовление буферных растворов
- •Тема 5. Электрохимия
- •Работа 10. Потенциометрический метод определения рН растворов при помощи стеклянного электрода
- •Тема 6. Поверхностные явления. Хроматография
- •Работа 11. Разделение минеральных солей на колонках с твердым адсорбентом
- •Работа 12. Радиальная распределительная хроматография
- •Тема 7. Дисперсные системы
- •Работа 13. Метод замены растворителя
- •Работа 14. Получение золя гидроксида железа (III)
- •Работа 15. Получение золя гексацианоферрата (II) меди
- •Работа 16. Изучение процесса коагуляции коллоидных растворов
- •Тема 8. Растворы вмс
- •Работа 17. Изучение процесса денатурации белка
- •Работа 18. Изучение процесса высаливания белка
- •Биоорганическая химия
- •Тема 1. Спирты, фенолы
- •Тема 2. Тиолы, амины
- •Тема 3. Альдегиды и кетоны
- •Тема 4. Карбоновые кислоты
- •Работа 16. Обнаружение фенольного гидроксила в карбоновых кислотах
- •Тема 5. Аминокислоты. Белки
- •Работа 20. Нингидриновая реакция на α-аминокислоты
- •Тема 6. Липиды
- •Тема 7. Углеводы
- •Дисахариды. Полисахариды
- •Тема 8. Нуклеиновые кислоты
- •Литература
Тема 7. Углеводы
В этом разделе представлены работы по изучению химических свойств углеводов. Углеводы относятся к гетерофункциональным веществам и являются важными в биологическом отношении природными органическими соединениями. Важная роль в жизнедеятельности всех организмов принадлежит гетерополисахаридам (гликозаминогликанам).
Задача работ: изучить основные химические свойства моно-, ди- и полисахаридов, их качественные реакции.
Оборудование, материалы: 1 %-ные растворы глюкозы; сахарозы; лактозы; фруктозы; 10 %-ные растворы гидроксида натрия и серной кислоты; 2 %-ный раствор сульфата меди (II); раствор йода; реактив Селиванова (0,5 %-ный раствор резорцина в 20 %-ном водном растворе НС1); этиловый спирт; 0,5 %-ный раствор крахмала.
Работа 26. Общая реакция на углеводы (реакция Подобедова - Молиша)
Выполнение работы: В четыре пробирки наливают по 1 мл растворов различных углеводов, добавляют по 2 капли 10%-ного спиртового раствора -нафтола (канцероген) и осторожно по стенке наслаивают концентрированную серную кислоту, которая опускается на дно пробирки. На границе слоев образуется красно-фиолетовое кольцо. При взбалтывании смесь разогревается и окрашивается по всему объему.




 HC
CH
HC
CH


 HO-CH CH-OH
H
HO-CH CH-OH
H

 to
HC C C = O
to
HC C C = O


 H-C-H
C-H
+ 3 H2O
H-C-H
C-H
+ 3 H2O


 H O
H O
OH HO C=O
пентоза фурфурол







 HCCHOH
HCCHOH

 H
H



 HCCC=O+
красно – фиолетовое
HCCC=O+
красно – фиолетовое
окрашивание
O
фурфурол -нафтол


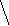







 HCCH
HCCH
 HO-CHCH-OHH
HO-CHCH-OHH


 to
C C C = O
to
C C C = O

 H-C C-H
+ 3 H2O
H-C C-H
+ 3 H2O
 HO-CH2
H HO-CH2
O
HO-CH2
H HO-CH2
O
OH HO C=O
гексоза оксиметилфурфурол
Работа 27. Доказательство наличия гидроксильных групп в глюкозе
Выполнение работы: к 0,5 мл 1%-ного раствора глюкозы прибавляют 3 мл 10%-ного раствора гидроксида натрия и 3 - 4 капли 1%-ного раствора сульфата меди (II). Образующийся вначале осадок гидроксида меди (II) растворяется и образуется прозрачный раствор глюкозата меди (II) темно - синего цвета.
 Н
Н
Н
Н
 С = О С
= О
С = О С
= О
 Н-С-ОН Н-С-ОН
Н-С-ОН Н-С-ОН

 НО-С-Н + Сu(OH)2НО-С-Н + 2H2O
НО-С-Н + Сu(OH)2НО-С-Н + 2H2O
Cu
 Н-С-ОН Н-С-О
Н-С-ОН Н-С-О







 Н-С-ОН Н-С-О
Н-С-ОН Н-С-О
СН2ОН СН2ОН
глюкоза глюкозат меди
(сахарат меди)
Аналогичный результат дают другие моносахариды. Образуются соответствующие сахараты меди (II), которые по структуре являются хелатными соединениями.
Работа 28. Реакция окисления глюкозы гидроксидом меди (II)
(реакция Троммера)
Выполнение работы: в пробирку наливают 1 мл 1%-ного раствора глюкозы, добавляют 1 мл 10%-ного раствора гидроксида натрия и 5 капель 1%-ного раствора сульфата меди (II) до появления исчезающей при встряхивании мути. Смесь взбалтывают и нагревают верхний слой до кипения, но не кипятят. Наблюдается появление желтого осадка гидроксида меди (I), переходящего в осадок оранжево – красного цвета оксида меди (I).
Необходимо помнить, что избыток гидроксида меди (II) при длительном кипячении дает оксид меди(II) черного цвета, а при недостатке Cu(OH)2 - из глюкозы образуются продукты осмоления. Все это маскирует истинный оранжевый цвет осадка оксида меди (I).

 НOН
НOН

 С = О
С = О
С = О
С = О
 Н-С-ОН
t0Н-С-ОН
Н-С-ОН
t0Н-С-ОН





 НО-С-Н + Сu(OH)2НО-С-Н +Cu2O+ 2Н2О
НО-С-Н + Сu(OH)2НО-С-Н +Cu2O+ 2Н2О
 Н-С-ОН
Н-С-ОН
Н-С-ОН
Н-С-ОН

 Н-С-ОН
Н-С-ОН
Н-С-ОН
Н-С-ОН
СН2ОН СН2ОН
глюкоза глюконовая кислота
Все альдозы дают положительную реакцию Троммера, при этом образуются соответствующие гликоновые кислоты.
Заметим, что реакция окисления с Cu(OH)2 характерна как для альдоз, так и для кетоз, так как в щелочной среде в присутствии окислителя углеродные цепи молекул кетоз могут расщепиться с образованием веществ, которые тоже окисляются и дают осадок характерного цвета.
Работа 29. Реакция окисления глюкозы реактивом Фелинга
(реакция Фелинга)
Выполнение работы: в пробирку наливают 1 мл реактива Фелинга и такой же объем 1%-ного раствора глюкозы. Верхнюю часть пробирки нагревают до начинающегося кипения. Верхний слой смеси окрашивается сначала в желтый цвет (осадок Cu(OH)), а затем в красно – оранжевый, так как образуется осадок Cu2O.

 НOН
НOН

 С = О
С = О
С = О
С = О
 Н-С-ОН СООК
t0Н-С-ОНCOOK
Н-С-ОН СООК
t0Н-С-ОНCOOK
Cu












 НО-С-Н + 2 СН-О
НО-С-Н +Cu2O+ 2CH-OH
НО-С-Н + 2 СН-О
НО-С-Н +Cu2O+ 2CH-OH
 Н-С-ОН СН-О +2Н2О
Н-С-ОНCH-OH
Н-С-ОН СН-О +2Н2О
Н-С-ОНCH-OH

 Н-С-ОН СООNaН-С-ОНCOONa
Н-С-ОН СООNaН-С-ОНCOONa
СН2ОН СН2ОН
глюкоза медный глюконовая сегнетова
алкоголят кислота соль
сегнетовой соли
Реакцию Фелинга чаще всего используют для доказательства наличия глюкозы в биологических жидкостях, так как в данном случае исключается образование черного осадка CuО.
Примечание: степень гидролиза реактива Фелинга пропорциональна количеству глюкозы в исследуемом растворе, поэтому реакция Фелинга предпочтительнее реакции Троммера.
Работа 30. Реакция окисления глюкозы реактивом Гайнеса
(реакция Гайнеса)
Выполнение работы: в пробирку наливают 1 мл реактива Гайнеса и такой же объем 1%-ного раствора глюкозы. Верхний слой смеси нагревают до начала кипения. Он окрашивается сначала в желтый цвет (осадок Cu(OH)), а затем в красно – оранжевый, так как образуется осадок Cu2O.
Реакцию Гайнеса используют для доказательства наличия глюкозы в биологических жидкостях. Преимущество реакции - высокая чувствительность и исключение возможности образования черного осадка оксида меди (II).
Работа 31. Реакция окисления глюкозы реактивом Бенедикта
(реакция Бенедикта)
Выполнение работы: в четырех пробирках смешивают по 1,5 мл реактива Бенедикта и 1 мл раствора глюкозы различной концентрации – 0,1%, 0,7%, 1%, 3%. Верхний слой нагревают до начала кипения. В пробирках развивается различное окрашивание в зависимости от концентрации моносахарида – от зеленого до оранжевого. При зеленой окраске без наличия осадка проба отрицательна.
Проба Бенедикта самая чувствительная и лучшая из проб на восстанавливающие сахара, например глюкозу в моче. При тщательном соблюдении условий опыта цвет осадка зависит от концентрации альдозы и поэтому реакцию считают полуколичественной.
Работа 32. Реакция окисления глюкозы гидроксидом висмута (III)
(реакция Ниландера)
Выполнение работы: в пробирку наливают 1 мл 1%-ного раствора глюкозы и 1 мл реактива Ниландера. Содержимое пробирки доводят до кипения. При дальнейшем нагревании жидкость постепенно желтеет, затем становится темно- коричневой; в итоге образуется черный осадок металлического висмута.










 НOН
НOН
С = О С = О
Н-С-ОН t0Н-С-ОН
 3 НО-С-Н + 2Bi(OH)33 НО-С-Н + 2Bi↓ + 3H2O
3 НО-С-Н + 2Bi(OH)33 НО-С-Н + 2Bi↓ + 3H2O
Н-С-ОН Н-С-ОН
 Н-С-ОН
Н-С-ОН
Н-С-ОН
Н-С-ОН
СН2ОН СН2ОН
глюкоза глюконовая кислота
Реакция Ниландера самая чувствительная на глюкозу в моче.
Работа 33. Реакция Селиванова на фруктозу
Выполнение работы: в пробирку наливают 0,5 мл 1 %-ного раствора фруктозы и 0,5 мл реактива Селиванова, содержащего соляную кислоту и резорцин. Содержимое пробирки кипятят 1 -2 минуты, жидкость окрашивается в вишнево-красный цвет.



 СH2OH
HC CH
СH2OH
HC CH


 С = O t 0,
HCl O
С = O t 0,
HCl O



 НО-С-НCCC–H+ 3H2O
НО-С-НCCC–H+ 3H2O
 Н-С-ОН
Н-С-ОН
 Н-С-ОНHOCH2O
Н-С-ОНHOCH2O
СН2ОН
фруктоза оксиметилфурфурол



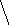


 HCCHOH
HCCHOH

 OHClвишневое
OHClвишневое

 CCC–H+ окрашивание
CCC–H+ окрашивание
 OH
OH
HOCH2O
резорцин
Реакция используется для открытия фруктозы в моче детей при врожденном заболевании, называемом фруктозурией.
Работа 34. Реакция Биаля на пентозы (с орцином)
Выполнение работы: в пробирку наливают 1 мл реактива Биаля, содержащего орцин, соляную кислоту, FeCl3, и нагревают до кипения, затем добавляют 5-6 капель 1% -ного раствора арабинозы или другой пентозы. Через 2-3 минуты проявляется зеленое окрашивание (гексозы дают коричневое окрашивание).


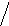
 H- С =OHCCH
H- С =OHCCH


 H-С -OHt0O
H-С -OHt0O


 НО-С-НHCCC–H+ 3H2O
НО-С-НHCCC–H+ 3H2O
 HO-С-Н
HO-С-Н
СH2ОНO
L- арабиноза фурфурол


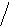


 HCCHOH
HCCHOH

 OHClзеленое
OHClзеленое

 HCCC–H+FeCl3окрашивание
HCCC–H+FeCl3окрашивание

 H3COH
H3COH
O
орцин
(5-метилрезорцин)
Реакция используется для открытия пентоз в моче детей при наследственном заболевании пентозурией.
