
- •Програма курсу “обробка технологічних рідин та стічних вод”
- •1. Вступ. Мета та задачі курсу. Структура дисципліни
- •Характеристика стічних вод
- •Класифікація шкідливих домішок, та основні методи очищення
- •3. Методи обробки технологічних рідин та стічних вод Прояснення рідин від грубо дисперсних завислих речовин
- •Обробка рідин в циклонах
- •Обробка рідин відстоюванням
- •Фільтрування
- •Флотація
- •Очищення рідин від колоїдно-дисперсних речовин
- •Механізм очищення води коагулянтами
- •Очищення води флокулянтами
- •Відокремлення завислих речовин центрифугуванням
- •Очищення вод хімічним осадженням
- •Видалення з води розчинних газів
- •Іонообмінне очищення рідин
- •Очищення рідин адсорбцією
- •Очищення рідин екстракцією
- •Очищення рідин мембранними та електромембранними методами
- •Очищення стічних вод виморожуванням та кристалізацію газогідратів
- •Біологічне очищення води
- •Радіаційний методи очищення води
- •Завдання на практичні заняття
- •Розглянути типи відстійників
- •Розглянути конструкції освітлювачів
- •Ознайомитися методикою розрахунку елементів освітлювача на прикладі
- •Розглянути схеми та конструкції очищення методом флотації
- •Розглянути конструкції дегазаторів та методику їх розрахунків
- •Розглянути приклади розрахунків по дегазації води
- •Розглянути основні види адсорберів
- •Розглянути розрахунок адсорбційної установки
- •Розглянути стадії роботи йонітових фільтрів та приклади технологічних схем обробки води
- •Приклади технологічних схем обробки води
- •Розглянути основні конструкції аеротенків
- •Завдання на самостійну проробку
- •Перелік та ключ до вибору свого варіанту для контрольної роботи
- •Питання до контрольної роботи та екзамену
- •Перелік основної та додаткової літератури Основна література
- •Додаткова література
Очищення рідин мембранними та електромембранними методами
Давно було відомо, що завдяки еволюції живих організмів виробився найбільш універсальним досконалий метод розділення рідинних систем крізь напівпроникні біологічні мембрани, які забезпечують спрямоване перенесення речовин у клітини і з клітин живих організмів. Ця унікальна властивість напівпроникних мембран пропускати одні речовини і затримувати інші (причому цей процес відбувається з низькими енергетичними затратами) давно приваблювала дослідників з метою її використання для вирішення технологічних проблем, у тім числі й доочищення води від різних видів розчинних і нерозчинних домішок. Однак ідея застосування мембран для технологічних потреб стала реальністю лише тоді коли було досягнуто необхідного рівня знань про природу та структуру натуральних і синтетичних матеріалів, насамперед полімерів.
До основних мембранних процесів, що нині успішно використовуються для розділення рідинних систем, утім числі й очищення вод, належать: зворотній осмос, нанофільтрування, ультрафільтрування, мікрофільтрування, діаліз, первапорація, мембранна дистиляція, електродіаліз та ін,
У будь-якому з перелічених мембранних процесів розчин, що підлягає розділенню, обов'язково контактує з напівпроникною мембраною з одного її боку. Внаслідок напівпроникності мембрани розчин, що проходить крізь неї, збагачується на один із компонентів (як правило, розчинником – водою). Часом процес відбувається настільки ефективно, що отриманий фільтрат практично не містить домішок. Водночас, використовуючи той чи інший мембранний процес можна отримати в розчині над мембраною концентрат без домішок речовин здатних проникати крізь мембрану.
Рушійною силою мембранних процесів є різниця з обох боків мембрани робочого тиску в так званих баромембранних процесах (зворотний осмос, ультрафільтрування, нанофільтрування, мікрофільтрування); парціального тиску пари розчинника (води) в мембранній дистиляції і первапорації; концентрації розчиненої речовини в діалізі; електричного потенціалу в електродіалізі.
Нижче розглянуто найважливіші мембранні процеси (за винятком електродіалізу) та межі їх застосування, зокрема для очищення стічних вод.
Зворотний осмос – це процес фільтрування розчинів під тиском крізь напівпроникні мембрани, які пропускають розчинник (воду) і повністю або частково затримують молекули чи йони розчинених речовин. В основі цього мембранного процесу лежить явище осмосу – самовільного проникнення розчинника крізь напівпроникну мембрану в розчин. Гідростатичний тиск, за якого встановлюється динамічна рівновага потоку розчинника крізь мембрану, відповідає осмотичному тиску розчину даної концентрації. Якщо ж з боку розчину прикласти тиск, який перевищує осмотичний то розчинник буде переноситись у зворотному напрямку, що відображено в назві процесу – зворотний осмос (раніше цей процес називався гіперфільтрацією),
Ультрафільтрування – це процес баромембранного розділення, а також концентрування і фракціонування розчинів високомолекулярних сполук. Він відбувається під дією різниці тисків з обох боків мембрани, що становить 0,05–0,5 МПа. Залежно від цілей ультрафільтрувального процесу мембрани пропускають розчинник і переважно (або тільки) низькомолекулярні сполуки (розділення високо- і низькомолекулярних сполук і концентрування високомолекулярних сполук);
тільки розчинник (концентрування високомолекулярних сполук);
розчинник і фракції високомолекулярних сполук з певними молекулярною масою чи розміром макромолекулярних клубків (фракціонування полімерних сполук).
Ультрафільтрування, на відміну від зворотного осмосу, застосовують для розділення систем, в яких молекулярна маса розчинених компонентів набагато більша за молекулярну масу розчинника (води). На практиці ультра-фільтрування використовують тоді, коли хоча б один із компонентів розчину має молекулярну масу понад 500 дальтон.
Рушійною силою процесу ультрафільтрування, як і зворотного осмосу, є різниця тисків з обох боків мембрани, але, оскільки осмотичні тиски розчинів високомолекулярних сполук, як правило, низькі порівняно з робочим тиском, то під час визначення параметрів ультрафільтрування їх не враховують. Якщо ультрафільтрувальна мембрана не здатна затримувати низькомолекулярні сполуки (особливо електроліти), то і в цьому разі осмотичні тиски розчинів низькомолекулярних сполук також на враховуються під час визначення рушійної сили процесу.
Ефективність ультрафільтрувального розділення розчинів речовин визначають за конкретним співвідношенням двох основних складових процесу – рівноважної і нерівноважної. Якщо внесок рівноважної складової, який виражається через коефіцієнт розподілу розчиненої речовини між мембраною і розчином, буде меншим, то за всіх інших однакових умов мембрана краще затримуватиме дану розчинену речовину. В разі ультрафільтрування основний внесок у визначенні величини коефіцієнта розподілу належить стеричним обмеженням, зазвичай з урахуванням важливої ролі поверхневих властивостей мембран (гідрофільності, заряду, хімічної природи функціональних груп тощо).
Нанофільтрування – це баромембранний процес розділення речовин ( за робочих тисків 1–2 МПа) з молекулярними масами до 300–500 дальтон. У процесі нанофільтрування частково затримуються низькомолекулярні електроліти (наприклад, хлорид натрію - на 40-60 %, а солі з двозарядними ІІІ - ми - на 80-90 %) і практично повністю (98-99,9 %) органічні сполуки спирти, барвники, цукрі, пестициди та ін.). Вважають, що нанофільтрувальні мембрани мають пори нанометричного діаметра (1-3 нм) в ультра тонкому розцілювальному шарі, що і дало їм назву. Однак, як показали останні дослідження, цей шар нанофільтрувальних мембран може бути непористим, але хімічно рідкозшитим і високогідрофільним (часто з йоногенними групами). Детальніші дослідження масоперенесення крізь нанофільтрувальні мембрани переконують, що цей процес за механізмом розділення є зворотноосмотичним і те-мін "нанофільтрування" не відображає якогось особливого процесу, відмінного від зворотного осмосу та ультрафільтрування на тонкопористих заряджених мембранах. Низький робочий тиск і вузький діапазон молекулярних мас речовин, що розділяються на цих мембранах, пов'язані лише з їхньою особливою макро- і мікроструктурою (багатошаровість, ультратонкі селективні шари, в яких відсутні мікродефекти, з високсгідрофільними та йоногенними групами).
Нанофільтрувальні мембрани і нанофільтрування в останні 5-10 років широко застосовують для обробки природних і стічних вод. Зокрема, нанофільтруванням замінюють коагуляцію і фільтрування, зм'якшують воду. Так, у разі обробки солонуватих вод (загальний вміст розчинених речовин до 300 мг/дм3) забарвленість води знижується на 96 %, вміст загального органічного вуглецю – на 84 %, затримування сульфатів досягає 96 %. У деяких країнах (Франція, США) нанофільтрування використовують для підготовки питної води без традиційної хімічної і фізико-хімічної обробки води, що забирається з відкритих поверхневих водойм.
Крім водоочищення природних і стічних вод нанофільтрування широко застосовують у харчовій (прояснення соків, обробка пива, столових мінеральних вод та інших напоїв, молока і молочної сироватки тощо), фармацевтичній промисловості та біотехнології.
Мікрофільтрування – це баромембранний процес, який застосовують для відокремлення від розчинника завислих та колоїдних часточок розміром 3,1–10 мкм. Рушійною силою процесу є різниця тисків з обох боків мембрани, становить 0,01-0,05 МПа. Мікрофільтрувальні мембрани з середнім розміром пор 0,05–10 мкм виготовляють у вигляді полімерних плівок, трубок або порожнинних волокон з розчинів гідрофобних і гідрофільних полімерів. Є також інші методи одержання полімерних мікрофільтрувальних мембран: спікання порошків полімерів і порошкових композицій; з волокон і волокнистих дисперсій полімерів; з макромонолітних плівок після їхнього механічного витягування в адсорбційно-активних середовищах або їх травлення після опромінення частинками з високою енергією (трекові, або ядерні, мембрани).
Останнім часом все ширше застосовують керамічні мікрофільтри у вигляді пластин (дисків) або трубок, які одержують спіканням дисперсних порошків оксидів алюмінію, титану, цирконію тощо. Неорганічні мікрофільтри одержують також методом золь-гель-технології під час гідролізу відповідних алкоксидів металів з подальшими нанесенням утворених золів на пористу керамічну підкладку і термообробкою за відносно невисоких температур (400–800°С).
Діаліз – це мембранний процес, рушійною силою якого є градієнт концентрацій розчинених речовин з обох боків мембрани. Діаліз відбувається з використанням непористих (дифузійних) мембран і застосовується для розділення речовин, що значно відрізняються за молекулярною масою (наприклад, розчини полімерів очищають від низькомолекулярних електролітів та інших сполук).
Недоліком методу є його низька продуктивність і великі об'єми розчинника, що багаторазово замінюється з одного боку мембрани. Діаліз раціональне використовувати в технологічних процесах після ультра- або мікрофільтрувального концентрування розчинів високомолекулярних сполук чи колоїдів.
Первапорація – це мембранний процес, який відбувається з використанням непористих мембран для вилучення з води невеликих домішок органічних речовин (спиртів, ацетону, бензолу, толуолу, хлорпохідних аліфатичних і ароматичних вуглеводнів тощо) або для видалення домішок води з цих речовин. Необхідною умовою первапораційного розділення є здатність полімерної мембрани набрякати в речовинах, що є домішками. В зв'язку з цим у першому випадку використовують мембрани на основі гідрофобних полімерів, які добре набрякають в органічних розчинниках, а в другому – високогідрофільні мембрани, які добре набрякають у воді. Рушійною силою процесу первапорації є різниця парціальних тисків пари або градієнт концентрації розчиненої речовини з обох боків мембрани, які створюються за рахунок різниці температур або тисків.
Найширше первапорацію використовують для очищення стічних вод від органічних розчинників, деяких інших сполук та для дегідратації спирти (насамперед етилового), що утворюють азеотропні суміші спирт – вода.
Мембранна дистиляція – це процес, рушійною силою якого є різниця парціального тиску пари розчинника (води) з обох боків гідрофобної мікро-фільтрувальної мембрани, яка створюється за рахунок різниці температур вихідного розчину і фільтрату. Як правило, температура розчину, що концентрується, становить 50–80°С, а фільтрату – 20–25°С. Отже, для проведення мембранної дистиляції можна використовувати низькоенергетичну теплоту. Крім цього, для мембранної дистиляції, що не є баромембранним процесом, не потрібен надлишковий робочий тиск, як у разі мікро-, ультра- та нанофільтрування і зворотного осмосу.
Мембранна дистиляція цікава насамперед як метод очищення та опріснення води, а також концентрування водних технологічних розчинів
Процес мембранної дистиляції можна проводити в різних технологічних варіантах: 1) контактна мембранна дистиляція – процес, в якому рідина контактує безпосередньо з обома боками мембрани; рідина (вода), що омиває холодний (приймальний) бік мембрани, є середовищем для конденсації пари, яка переноситься крізь пори мембрани з гарячого її боку; 2) мембранна дистиляція крізь газовий (паровий) прошарок – процес, в якому пара конденсується за приймальним боком мембрани на охолодженій поверхні, розміщеній на певній відстані від мембрани; рідина, що конденсується, не контактує з мембраною; 3) вакуумна мембранна дистиляція – процес, в якому створюється певне розрідження в зазорі між корпусом мембранного елемента і приймальним боком мембрани; дистилят конденсується за межами мембранного модуля; 4) мембранна дистиляція в газовому потоці – процес, в якому газовий потік (як правило, азот) подається з певною швидкістю вздовж приймального боку мембрани, а пара, що ним виноситься, конденсується за межами мембранного модуля; 5) осмотична мембранна дистиляція – процес, що відбувається за рахунок високої концентрації розчину з приймального боку мембрани, при цьому виникає різниця парціальних тисків пари і вона проникає крізь пори гідрофобної мембрани з розчину з низьким осмотичним тиском у потік висококонцентрованого розчину з високим осмотичним тиском; процес концентрування може відбуватися за кімнатної температури.
З усіх згаданих типів мембранної дистиляції на практиці найширше застосовують контактну мембранну дистиляцію.
Отже, щоб відбувався процес мембранної дистиляції, потрібно: 1) пориста мембрана, яка не повинна змочуватися розчином, що розділяється; 2) відсутність капілярної конденсації всередині пор мембрани; 3) перенесення крізь пори мембрани тільки пари; 4) відсутність зміщення мембраною рівноваги пара – рідина в процесі розділення компонентів; 5) безпосередній контакт з рідиною принаймні з одного боку мембрани; 6) градієнт парціального тиску в паровій фазі, що є рушійною силою масоперенесення для кожного компонента розчину.
На практиці мембранну дистиляцію застосовують як високоефективний метод: одержання чистої і високочистої води з вод різної солоності і забрудненості (в тім числі і з морської води); очищення стічних вод, що містять нелеткі неорганічні електроліти та органічні речовини; концентрування солей з промивних вод гальванічних та барвників фарбувальних виробництв; концентрування розчинів розбавлених нелетких мінеральних кислот та лугів; концентрування цукрових та глюкозо-фруктозних сиропів, термолабільних біологічно активних речовин (вітамінів, ферментів, білків тощо).
Н
Рис. 3. Схема
електродіалізного апарата:
1 – розсольна
камера; 2 – дилюатна камера; 3 – відведення
аноліту; 4 – анод;
5 – приелектродна
камера; 6 – катод; 7 – відведення католіту;
8 – прокладки турбулізатора
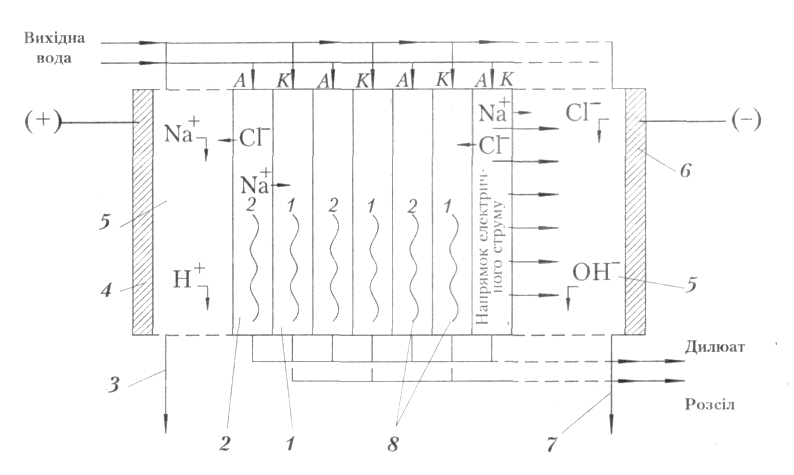
Електродіаліз – це процес перенесення йонів електроліту крізь селек-тивні йонообмінні мем-брани під дією постійного електричного струму. Швидкість перенесення іонів визначається силою струму. Дифузія, осмос і електроосмос знижують ефективність електродіа-ліззу.
Електродіалізний апарат розділяють на камери аніоно- (А) та кат іонообмінними (К) мем-бранами, які чергуються. Відстань між ними стано-вить 0,5–1,5 мм. У дилю-атних камерах 2 (Рис. 3) відбувається знесолювання, а в розсольних камерах 1 – концентрування розчину. Розсольні і дилюатна камері-утворюють комірку. Герметичність камер і розподіл потоків розчину забезпечують спеціальні прокладки. У промислових апаратах між електродами розміщують 250–500 комірок.
Крізь аніонообмінні мембрани мігрують аніони, а крізь катіонообмінні – катіони. Катіони переміщуються в напрямку проходження електричного струму а аніони – в протилежному напрямку. Всі комірки послідовно живляться постійним електричним струмом і паралельно або послідовно знесолюваною водою розсіл і дилюат виводять з апарата окремо. Дилюатні і розсольні камери утворюють окремі гідравлічні прямотечійні або циркуляційні системи. На кінцях апарата розміщені електроди. З ними стикаються електродні камери, в яких циркулює знесолювана вода, розсіл або спеціальний розчин електроліту, Затрати енергії зменшуються у разі послідовного сполучення великого числа електролізних комірок. У багатокамерному апараті два електроди обслуговують велике число камер. Перенапруга на електродах становить невелику частку від усіх омічних втрат.
Перевагою електродіалізу перед іншими методами є відсутність фазового перетворення води, яке простежується під час дистиляції, виморожування чи застосування газогідратного методу. Споживання енергії пропорційне вмісту солей у знесолюваній воді; обробляють стічні води за невисоких температур І тиску, що дає змогу використовувати широкий асортимент корозійностійких матеріалів і автоматизувати процес.
Однак цей метод не позбавлений і недоліків, до яких належать утворення осадів карбонату кальцію, гідроксиду магнію та гіпсу в разі роботи в умовах поляризації;.
• "отруєння" катіонообмінних мембран залізом, марганцем, а аніонообмінних – органічними речовинами, які містяться в оброблюваній воді;
• у разі роботи установки на струмі граничної густини, нижчої від оптимальних значень, значно зростає вартість процесу;
• внаслідок відсутності апаратів великої одиничної потужності збільшуються питомі капітальні та експлуатаційні затрати.
Очищення рідин випарюванням, дистиляцією ректифікацією, відморожуванням і кристалізацією газогідратів.
