
- •Розділ 5. Розчини
- •5.1. Загальні поняття про розчини
- •249,7Г(CuSo4· 5h2o) містять 159,6 г/CuSo4 )
- •100 Г розчину містять 15г h2so4
- •100 Г розчину містять 9 г нCl
- •5.2. Розчини неелектролітів
- •5.3. Розчини електролітів
- •Константа дисоціації при 2025 с
- •5.4. Гідроліз солей
- •5. Добуток розчинності
- •Питання і задачі
Константа дисоціації при 2025 с
Кд = ([H+][OH−]) / [H2O] = 1,8 .10−16.
Оскільки ступінь дисоціації дуже малий, концентрація води практично стала: [H2O] = const = 1000/18 = 55,5 моль/л. Тоді Кд· [H2O] = 1,8·10−16 · 55,5 = 10−14. Добуток Кд·[H2O] називається іонним добутком води і позначається Кw. Кw = [H+][OH−] = 10−14.
В чистій воді [H+] = [OH−] = 10−7 моль/л. При додаванні кислоти збільшується концентрація [H+] і зменшується концентрація іонів [OH−], при додаванні лугу – навпаки.
На практиці для характеристики кислотності середовища використовують водневий показник рН = lg [H+]. Так, в чистій воді [H+] = [OH−] =10−7; pH = 7; в кислому середовищі [H+] > [OH−], pH < 7; в лужному середовищі [H+] < [OH-], pH > 7.
Нейтральне середовище
кисле середовище [Н+] [ОН–] лужне середовище [Н+] < [ОН–][Н+]
С(Н+) 100 10−1 10–2 10−3 10−4 10−5 10−6 10−7 10−8 10−9 10−10 10−11 10−12 10−13 10−14
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14

збільшення кислотності збільшення лужності
Приклад 3.
Визначити рН 0,01 М розчину гідроксиду амонію, якщо Кд = 1,77·10−5.
Розвязання:
1. − ?
NH4OH ↔ NH4+ + OH−; [OH−] = Cn , де С − молярна концентрація електроліту,
– ступінь дисоціації, n – кількість іонів даного виду, отриманих при дисоціації (у даному випадку n =1).
=
![]() ,
=
,
=
![]() =
=
![]() =
0,042.
=
0,042.
2. [OH−] − ?
[OH−] =10−2·0,042·1 = 0,42 ·10−3 моль/л,
або [OH−]
=
![]() =
=
![]() =
0,42 ·10−3
моль/л,
=
0,42 ·10−3
моль/л,
3. pH − ?
pOH = −lg [OH−] = 3,7; pH + pOH = 14; pH = 14 – 3,7 = 10,3.
Відповідь: рН = 10,3
5.4. Гідроліз солей
Гідроліз – обмінна взаємодія між речовиною та водою. Аналогічні реакції для неводних середовищ називають сольволізом. Гідроліз – різновид іонних реакцій. Реакція нейтралізації між різними за силою кислотами та основами не завжди доходить до кінця внаслідок перебігу зворотного процесу – гідролізу солі, яка утворюється. Тому гідроліз солей – це процес зворотний реакціям нейтралізації. Більшість солей у розчинах дисоціює, наприклад:
CH3COONa ↔ Na+ + CH3COO−.
Певна доля молекул води дисоціює на іони Н+ та ОН−. Іони, які утворилися в наслідок дисоціації солі можуть взаємодіяти з іонами води з утворенням малодисоційованих сполук (слабких електролітів). У наведеному випадку
CH3COO− + Н+ ↔ CH3COOН
Тоді реакцію гідролізу можливо записати у вигляді
CH3COONa + Н2О ↔ CH3COOН + NaOН ,
або в іонній формі
CH3COO−+ Н2О ↔ CH3COOН + ОН–
Таким чином суть гідролізу полягає в тому, що катіони або аніони солей, або обидва види іонів одночасно можуть звязувати відповідно іони ОН– або Н+, або ті та інші з утворенням слабкого електроліту (відповідно основи, кислоти або основи та кислоти одночасно).
Приклади сильних і слабких основ наводяться у розділі "Розчини електролітів".
Солі за реакцією гідролізу можна розділяють на декілька груп.
Сіль утворена катіонами сильної основи та аніоном сильної кислоти (NaCl, K2SO4, NaNO3), гідролізу не підлягає, тому що зворотна до гідролізу реакція нейтралізації відбувається до кінця.
Сіль утворена катіоном слабкої солі та аніоном сильної кислоти (AgNO3, NH4Cl, CuSO4) гідролізується за катіоном, при цьому у розчині зростає концентрація водню. Наприклад :
NH4Cl + Н2О ↔ NH4OН + HCl
NH4+ + Н2О ↔ NH4OН + H+, pH < 7.
Сіль утворена слабкою кислотою та сильною основою ( Na2CO3, K2S, KCN) гідролізується за аніоном, при цьому у розчині зростає концентрація іонів ОН−. Наприклад:
KCN + Н2О ↔ HCN + KOH
CN−+ Н2О ↔ HCN + ОН–, рH > 7.
Сіль утворена слабкою кислотою та слабкою основою (Al2S3, Fe2(CO3)3, (NH4)3PO4) гідролізуються за катіоном і аніоном. Наприклад:
Al2S3 + 6Н2О ↔ 2Al(OH)3 + 3H2S,
2Al3+ +3S2− + H2O ↔ 2Al(OH)3 + 3H2S, pH 7.
У цьому випадку реакція розчину залежить від відносної сили кислоти та основи, які утворюють сіль. Якщо константи дисоціації основи і кислоти приблизно дорівнюють одна одній, реакція розчину буде нейтральною.
Гідроліз солей, утворених слабкими багатоосновними кислотами, відбувається ступінчасто, переважно по першому ступеню, причому продукти гідролізу є кислі солі. Наприклад,
Na2CO3 + H2O ↔ NaHCO3 + NaOH,
CO32− + H2O ↔ HCO3−+OH−, pH>7.
Накопичення у розчині іонів ОН− запобігає подальшому процесу гідролізу по другому ступеню.
Сіль, утворена слабкою багатокислотною основою, також гідролізується переважно по першому ступеню з утворенням основних солей:
ZnCl2 + H2O ↔ ZnOHCl + H2O,
Zn2+ + H2O ↔ ZnOH+ + H+, рH<7
Кількісною характеристикою гідролізу є константа рівноваги, наприклад для реакції
КСN + H2O ↔ KOH + HCN;
CN− + H2O ↔OH− + HCN.
K=
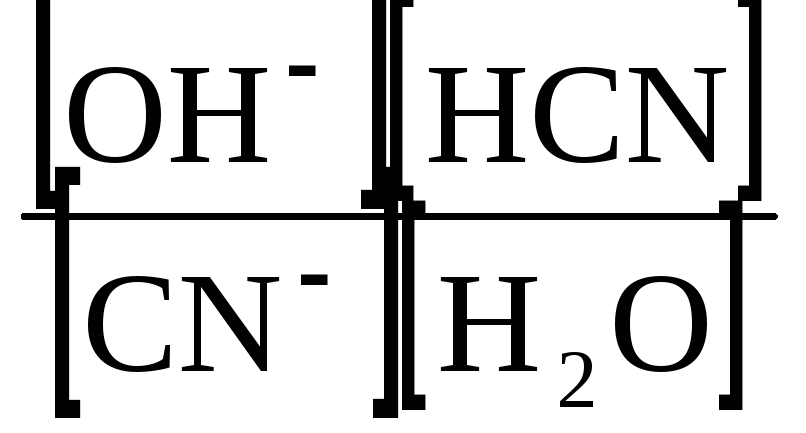 .
.
Концентрація води у розбавлених розчинах змінюється незначно і її можливо вважати сталою величиною, тоді
Кг
=
K[H2O]
=
![]() ,
,
вважаючи що [OH−]
=
![]() ,
маємо Кг
=
,
маємо Кг
=
![]() =
=![]() ,
деКHCN
=
,
деКHCN
=
![]() − константа дисоціації слабкої кислоти.
− константа дисоціації слабкої кислоти.
Для гідролізу солі утвореної катіонами слабких основ та аніонами сильних кислот, маємо:
Кг
=
![]() .
.
Константа гідролізу солей утворених катіонами слабких основ та аніонами слабких кислот, має вигляд:
Кг
=
![]() ,
деКосн
–
константа
дисоціації слабкої основи.
,
деКосн
–
константа
дисоціації слабкої основи.
Крім того є ще одна характеристика гідролізу – це ступінь гідролізу (h) − відношення числа гідролізованих молекул до загальної кількості розчинених молекул. Ступінь гідролізу залежить від константи гідролізу (аналогічно закону розбавлення Оствальда), та концентрації солі і виражається у процентах або долях одиниці. На глибину гідролізу впливають тіж самі фактори, що і на іонні рівноваги взагалі: температура, концентрація солі та інші.
Приклад 4. Визначити ступінь гідролізу ацетату калію у 0,1 М розчині та рН розчину.
Розвязання:
Реакція гідролізу відбувається за рівнянням:
CH3COO−+H2O CH3COOH + OH−.
Знайдемо значення константи гідролізу:
1. Кг − ?
КCH3COOH = 1,8 · 10−5 (довідкові данні).
Кг = Кw/Kкисл = 10−14/1,8·10−5 = 5,56·10−10.
2. h − ?
Знайдемо ступінь гідролізу :
h
=
![]() =
7,5·10−5.
=
7,5·10−5.
4. [OH−] −?
Вихідна концентрація іонів OH−, які гідролізуються, дорівнює молярній концентрації розчину солі (См моль/л). Враховуючи ступінь гідролізу h вважаємо, що утворилось h·См моль/л іонів OH−.
[OH−] = h·См = 7,5 · 10−5·0,1 = 7,5·10−6 моль/л.
5. pH −?
pОH = −lg [OH−] = 5,12.
pH = 14 – pOH = 14 – 5,12 = 8,8.
Відповідь: h = 7,5·10−5; pH = 8,8.
Щоб зменшити процес гідролізу солі, необхідно готувати розчини високої концентрації та зберігати їх при низьких температурах. А також можливо додавати до розчину солі надлишок одного з продуктів гідролізу (кислоти або лугу)
