
- •Розділ 6. Окиснювально–відновні процеси і елементи електрохімії
- •6.1 Окиснювально–відновні процеси
- •Питання і задачі
- •Сформулюйте поняття «відновник». Наведіть приклади типових відновників.
- •6.2. Електроди і електродні реакції
- •6.3. Гальванічні елементи
- •Питання і задачі
- •6.4. Електроліз
- •Питання і задачі
- •6.5. Корозія металів
- •Питання і задачі
Питання і задачі
Що називається електродом? Які реакії відбуваються на ньому?
Що трапиться, якщо активний або неактивний метал занурити у розчин власної солі?
Дати визначення поняттям "потенціал" і "стандартний потенціал"? Як вони експериментально вимірюються і розраховуються?
Дати схему і пояснити дію водневого електрода.
Яка формулв встановлює залежність значення електродного потенціала від концентрації електроліта?
Дайте визначення поняттю "гальванічний елемент". З чого він складається?
Охарактеризуйте катоди і аноди у гальванічному елементі.
Наведіть умови оборотності гальванічного елемента. При якому стані його виконуються умови -DG0=А макс =nEF.
Що таке ЕРС гальванічного елемента і за якою вормулою розраховується ця характеристика?
Які типи гальванічних елементів ви знаєте? Чим вони відрізняються?
Навевсти приклади концентраційного гальванічного елемента.
Скласти схеми гальванічних елементів, в одному з яких мідь була б анодом, а у другому - катодом. Написати рівняння реакцій, які відбуваються на електродах при роботі цих гальванічних елементів та розрахуйте ЕРС, використавши стандартні значення потенціалів.
Гальванічний елемент складається з срібного електрода, зануреного у 1 M розчин AgNО3, та стандартного водневого електрода. Визначити його ЕРС. Написати електродні та сумарну реакції, які відбуваються у гальванічному елементі.
Напишіть схему концентраційного гальванічного елемента, складеного з цинкових електродів. Концентрація іонів цинку у розчинах дорівнює відповідно 0,1 та 0,5 моль/л. Розрахувати ЕРС та максимально корисну роботу, яку виконує цей гальванічний елемент.
У якому напрямку будуть рухатись електрони у зовнішньому колі наступних гальванічних елементів: а) MgMg+2Pd+2Pb; б) PbPb+2Cu+2Cu; в) CuCu+2Ag+Ag, якщо всі розчини електролітів одномолярні? Розрахуйте ЕРС цих елементів.
Розрахувати потенціал мідного електрода у розчині Сu(NО3)2 з концентра-цією іонів Сu+2 0,12 моль/л. Скласти з цього і стандартного мідного електродів гальванічний елемент та розрахувати його DG0. Як зветься такий гальванічний елемент?
6.4. Електроліз
Електролізом називається сукупність процесів, які відбуваються в електроліті при проходженні електричного струму, генеруємого зовнішнім джерелом. При електролізі електрична енергія перетворюється у хімічну. Цей процес проходить у електролізері - пристрої, який складається з послідовно підключених джерела постійного струму, амперметра, вольтметра і електродів, занурених у розчин або розплав електроліту, який знаходиться у електролізній вані.
У гальванічних елементах внаслідок процесів окиснення-відновлення, анод самодовільно заряджується негативно, а катод - позитивно.
 3
5
3
5
4 А
V
1 6 1
2
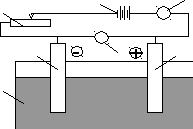
Рис 6. Схема електролізера для проведення електролізу.
1 анод і катод; 2 електролізна ванна з розплавом або розчином електроліту; 3 зовнішне джерело струму; 4 –реостат; 5 амперметр; 6 вольтметр.
При електролізі за допомогою зовнішнього джерела струму забезпечується зворотний процес і анод примусово заряджується позитивно, а катод - негативно.
Матеріали катода і анода повинні задовольняти певним вимогам. Катод мусить бути інертним (тобто не реагувати зі складовими електроліту) і вплив його речовини на катодну реакцію повинен бути мінімальним. Анод може бути інертним і активним. Інертні аноди виробляють з благородних металів (Pt), графіту, з металів і сплавів, які утворюють нерозчинну електропровідну плівку при окисненні (нержавіюча сталь).
Для забезпечення процесу електролізу необхідно, щоб зовнішня ЕРС була більшою, ніж ЕРС відповідного гальванічного елемента. Ця різниця витрачається на переборювання опору зовнішнього та внутрішнього кіл. Мінімальна напруга, при якої відбувається процес електролізу зветься напругою розкладу (Uрозк.).
Полярізація електродів
Полярізацією називається зміщення потенціалу електродів від рівноважних значень при проходженні крізь електрохімічну систему електричного струму (відбувається при електролізі та у гальванічних елементах). Існує два типи полярізації – концентраційна та електрохімічна.
Концентраційна полярізація зумовлена тим, що швидкість дифузії гідратованих іонів менше, ніж швидкість електрохімічних процесів. Цю полярізацію можна зменшити перемішуванням і нагріванням.
Електрохімічна полярізація зумовлена неоднаковою швидкістю руху іонів у електролітах та електронів у провідниках. Вона залежить від природи провідників, стану їх поверхні та густини струму на електроді.
Катодна полярізація зміщує потенціал катоду до більш негативних значень, анодна полярізація зміщує потенціал аноду до більш позитивних значень.
При електролізі процеси поляризації залежать ще й від густини струму на електродах. Густина струму і (D) – це відношення величини струму, якій подається у електролізну ванну до площини поверхні електроду.
і ( D) = I / S (А/дм2).
Чим більше густина струму, тим більше полярізація. Для зменшення електрохімічноі полярізації реальну площу поверхні збільшують, використовуючи пористі та губчасті електроди.
У загальному випадку ікат іан , оскількі найчастіше площі катоду і аноду не дорівнюють одна одній, але до електролізера поступає струм певної величини.
Перенапругою потенціалу електрода, або просто перенапругою називається різниця потенціалів поляризованого електрода і електрода у рівноважному стані при даній густині струму
= і – рівн
Катодна перенапруга завжди має знак мінус, анодна – знак плюс.
Особливе значення має перенапруга відновлення водню, оскількі у водному розчині завжди є іони водню. Вона залежить від матеріала електрода і стану його поверхні, значення рН, температури. Для деяких електродів вона досягає –2,0 В. Найменша вона на губчастому платиновому елекроді (і = рівн).
Для більшості іонів металів при умові відновлення на електроді тієї ж природи і невеликих значеннях густини струму перенапруга незначна і і = рівн.
Процеси на електродах
Порядок розряду іонів на електродах залежить від і, тобто від значення рівноважного (за стандартних умов стандартного) потенціала і від пере-напруги. На катодах у першу чергу відновлюються катіони з більшим значенням електродного потенціала. На анодах спочатку окиснюються іони з меншим значенням потенціала. Якщо немає значень перенапруги виділення конкретного іону, можна орієнтовно користуватися значенням стандартного електродного потенціала.
Процеси на катодах
При електролізі кислот, солей і основ на катодах відновлюються катіони металів і водню (з води або кислот) за наступними правилами:
Метали, які стоять у ряді напруг після водню завжди відновлюються з водних розчинів та розплавів у порядку зменшення їх потенціалів.
Сu2+ + 2ē Cu0; 0 = +0,34 В.
Метали, які стоять у ряді напруг до алюмінію включно відновлюються тільки з розплавів
Na+ + 1ē Na0 ; 0 = 2,70 В.
З водних розчинів замість них відновлюється водень з води, тому що потенціал реакції відновлення металу значно менше потенціалу відновлення водню:
2Н2О + 2ē Н2 + 2ОН- ; 0 = - 0,83 В,
або в кислих середовищах 2Н+ + 2ē Н2 ; і = 0,00 … 0,41 В при рН = 17).
Метали, які стоять у ряді напруг після алюмінію до водню теоретично можуть відновлюються на катоді разом з воднем. У більшості випадків реакцію відновлення водню можна довести до мінімуму збільшенням перенапруги іонів водню.
Fe2+ + 2ē Fe0; 0 = 0,44 В;
Zn2+ + 2ē Zn0; 0 = 0,76 В.
Процеси на анодах.
На анодах відбуваються процеси окиснення відновників у порядку збільшення їх потенціалів. Тому спочатку відбуваються процеси, які характеризуються найменшим значенням потенціалів.
Ці процеси відбуваються згідно зі наступними правилами.
1.Розчинні аноди окиснюються з утворенням відповідних іонів маталів:
Zn0 – 2ē Zn+2; 0 = 0,76 В;
Cu0 – 2ē Cu+2; 0 = + 0,34 В;
Це пояснюється тим, що більшість металів мають менший потенціал окиснення, ніж іони відновники, які є у електроліті.
2. На нерозчинних анодах (Pt, Pd, C), потенціал яких достатньо великий, відбувається процес окиснення компонентів електроліту згідно зі значеннями потенціалів реакцій:
а) якщо у електроліті є аніони безкисневих кислот, вони окислюються у першу чергу (крім іонів F- )
2Cl- – 2ē Cl2 ; і = 1,52 В (на платинових електродах)
2І- – 2ē І2 ; 0 = 0,53 В.
б) якщо у розчині є іони кисневмісних кислот, то вони не окиснюються на аноді внаслідок великого значення їх електродних потенціалів; замість них на аноді окиснюються молекули воли з виділенням кисню:
2SO4 2– 2ē S2O8 2– ; 0 = 2,01 В.
2H2O 4ē O2 + 4H+; і = 1,68 В (на платиновому електроді).
в) у випадку лужного середовища (наявність іонів ОН-) проходить реакція окиснення гідроксид-іонів:
4ОН- 4е О2 + 2Н2О; і = 0,4 В.
Наведемо декілька прикладів.
1.Електроліз води (інертні електроди, склад електроліта Н2О).
Дистильована вода електролізу не піддається, тому що є дуже слабким електролітом. Звичайна вода (водопровідна, природна) містить домішки солей, що підвищують її електропровідність і легко розкладається.
К: Н2О + 2ē Н2 + 2ОН-
А :
2Н2О
4ē
О2
+ 4Н+
:
2Н2О
4ē
О2
+ 4Н+
2 Н2О
елз
2Н2+
О2
Н2О
елз
2Н2+
О2
При електролізі води на катоді відновлюється водень, на аноді виділяється кисень. У прикатодному шарі електроліта (католіті) утворюється слабколужне середовище, у прианодному шарі (аноліті) слабкокисле середовище. Якщо відокремити католіт і аноліт можна отримати слабколужна воду, яку в народі називають "живою", внаслідок вираженої регенеруючої здатності і слабкокислу воду, яку називають "мертвою", тому що вона має антисептичні властивості. Електролітичний розклад води це промисловий спосіб отримання водню і кисню.
2. Електроліз розплаву NaCl (платинові електроди, в електроліті є іони Na+ та Сl–).
А: 2Сl– – 2ē Cl2
K: Na+ +1ē Na0
2
 NaCl
ел
з
2Na
+ Cl2.
NaCl
ел
з
2Na
+ Cl2.
При електролізі розплаву NaCl на катоді утворюється металічний натрій і на аноді газоподібний хлор. Цей процес є промисловим методом отримання цих речовин.
3. Електроліз розчину NaCl (платинові електроди, в електроліті є іони Na+, Сl– та молекули води) .
На аноді можливі два процеси:
А: 1. 2Н2О – 4ē О2 + 4Н+; 0 = 1,23 В ; = 0,45 В; і = 1,23 + 0,45 = 1,68 В.
2. 2Cl– – 2ē Cl2; 0 = 1,36 В; = 0,16 В ; і = 1,36 + 0,16 = 1,52 В.
У даному випадку на аноді будуть окиснюватися іони хлору, тому що реальний потенціал окиснення хлору менше, ніж потенціал окиснення води.
К: 2Н2О + 2ē Н2 + 2ОН-
А :
2Cl–
– 2ē
Cl2
:
2Cl–
– 2ē
Cl2
2 Н2О
+ 2Cl–
ел
з
Н2
+
2ОН–
+
Cl2
Н2О
+ 2Cl–
ел
з
Н2
+
2ОН–
+
Cl2
2 Н2О
+ 2NaCl
ел
з
Н2
+
2NaОН
+
Cl2.
Н2О
+ 2NaCl
ел
з
Н2
+
2NaОН
+
Cl2.
В цьому процесі на катоді буде виділятися водень, на аноді хлор, у розчині залишиться NaОН. При випаровуванні води добувають кристалічний луг NaОН (промисловий спосіб одержання твердого лугу).
4. Електроліз розчину Na2SO4 (інертні аноди, склад електроліту: Н2О , Na+, SO42–)
А: 2Н2О 4ē О2 + 4Н+
К :
2Н2О
+ 2ē
Н2
+ 2ОН–
:
2Н2О
+ 2ē
Н2
+ 2ОН–
2 Н2О
ел
з
2Н2
+О2.
Н2О
ел
з
2Н2
+О2.
В результаті електролізу цієї солі буде відбуватися розкладення води і концентрація солі буде зростати.
5. Електроліз солі CuSO4 з розчинними мідними анодами (склад електроліту Cu2+, SO42–, Н2О).
А: Сu0 – 2ē Cu2+
K :
Cu2+
+ 2ē
Cu0
:
Cu2+
+ 2ē
Cu0
С u0
+ Cu2+
ел
з
Cu2+
+ Cu0.
u0
+ Cu2+
ел
з
Cu2+
+ Cu0.
В результаті електролізу мідний анод розчиняється, на катоді відновлюється мідь, тобто відбувається перенесення речовини міді з аноду на катод.
6. Електроліз солі CuSO4 з нерозчинними анодами (склад електроліту Cu2+, SO42–, Н2О).
А: 2Н2О 4ē О2 + 4Н+
К :
Сu2+
+ 2ē
Cu0
:
Сu2+
+ 2ē
Cu0
2 Н2О
+ Сu2+
ел
з
О2
+ 4Н+
+
Cu0.
Н2О
+ Сu2+
ел
з
О2
+ 4Н+
+
Cu0.
2 Н2О
+ СuSO4
ел
з
О2
+ 2Н2SO4
+
Cu0.
Н2О
+ СuSO4
ел
з
О2
+ 2Н2SO4
+
Cu0.
В цьому процесі відбувається виділення міді на катоді, кисню на аноді, а у розчині утворюється сульфатна кислота.
Приклад 1. Описати процеси на електродах при електролізі розчину К2SO4.
Електроліз розчину К2SO4 (склад електроліту: Н2О, К+, SO42–).
А: 2Н2О 4ē О2+ 4Н+
 К:
2Н2О
+ 2ē
Н2+
2ОН-
К:
2Н2О
+ 2ē
Н2+
2ОН-
 Сумарний
процес: 2Н2О
ел
з
О2
+ 2Н2.
Сумарний
процес: 2Н2О
ел
з
О2
+ 2Н2.
В результаті електролізу цієї солі буде відбуватися розкладення води і концентрація солі буде зростати, тому що з водних розчинів К+ не буде відновлюватись внаслідок великого відємного потенціалу, а іони SO42- не будуть окиснюватися, тому що мають потенціал більше (0S2O82- 2SO42- = 2,01 В), ніж потенціал розкладення води до О2 та Н+ (0O2 + 4H+2H2O = 1,68 В).
Кількісні характеристики електролізу. Закони Фарадея
Маса речовини, яка перетворюється на електродах, залежить від кількості електричного струму, який пройшов крізь розчин або розплав електроліту. Між цими величинами є звязок, відомій під назвою законів Фарадея, або законів електролізу.
Перший закон Фарадея формулюється так: маси перетворених при електролізі речовин пропорційні кількості електрики, яка пройшла через електроліт:
m = kQ,
де m – маса перетвореної речовини; Q – кількість електрики, Кл або А.год; k – коефіцієнт пропорційності, який називається електрохімічним еквівалентом. k = МЕ/F, де МЕ – еквівалентна маса перетвореної речовини, МЕ =М(реч.)/n, n –кількість електронів у електродній реакції; F число Фарадея, 96500 Кл/моль (якщо час виражений у секундах), або 26,5 А .год/моль (якщо час виражений у годинах).
Математичним виразом другого закону Фарадея є рівняння:
m = МEIt/ F,
де t – тривалість електролізу, с або год; І величина сили струму, А.
Крім головного процесу при проходженні електричного струму крізь електролит відбувається багато побічних процесів. Частка кількості електрики, яка використовується для добування певного продукта характерізується виходом за струмом. Вихід за струмом це відношення кількості практично одержаної речовини і кількості теоретично одержаної речовини згідно з законом Фарадея:
= m пр / m теор.
Приклад 2. Визначити час, необхідний для добування 1 кг металічного натрію при електролізі розплаву натрій гідроксиду при силі струму 2500 А. Вихід за струмом () дорівнює 35 %. Який обєм кисню був добутий?
Розвязання:
Процеси на електродах (склад електроліту: ОH-, Na+).
А: 4ОН– 4ē 2Н2О + О2;
К: Na+ + 1ē Na.
t ?
Закон Фарадея: m = ME I t/F, t = m F/ ME I, ME(Na) = 23 г/моль. З урахуванням виходу за струмом t = m F/ ME I; t = (1000 . 96500)/(0,35 . 23 . 2500) = 4795 сек = 1год 20 хв.
3. V(O2) ?
V(O2) = VE I t /F, де VE обем електрохімічного еквівалента кисню.
VE = 5,6 л/моль. V(O2) = (5,6 . 2500 . 4795 . 0,35) / 96500 = 243,5 л.
Відповідь: t = 1год 20 хв, V(O2) = 243,5 л.
Використання електролізу у промисловисті
Акумулятори. Акумулятори – це оборотні гальванічні елементи. Речовини електродів і електролітів підбирають так, щоб при електролізі оборотність досягалась найменшими збитками енергії на побічні процеси та відділення теплоти. Цим вимогам задовольняють кілька електрохімічних систем.
Найпоширеним з акумуляторів є свинцевий або кислотний. Він складається з двох свинцевих решіток (електродів). До зарядження вічка решіток заповнюють пастою з РbO і гліцерину (як звязуюче). Оксид свинцю реагує з розчином сульфатної кислоти (30 %), в який занурено електроди, з утворенням нерозчинного плюмбум сульфату: РbO + H2SO4 PbSO4 + H2O.
Акумулятор заряджують, приєднавши його до джерела постійного електричного струму. При зарядженні відбувається процес електролізу і електрична енергія перетворюється на хімічну:
А (+): PbSO4 + 2H2O 2ē PbO2 + 4H+ + SO42–
 К
(–): PbSO4
+ 2ē
Pb0
+ SO42–
К
(–): PbSO4
+ 2ē
Pb0
+ SO42–
2PbSO4 + 2H2O PbO2 + Pb0 + 2H2SO4.
При пропусканні постійного струму крізь цю систему на позитивному електроді (аноді) Pb2+ окиснюється з утворенням PbO2, на негативному електроді (катоді) Pb2+ відновлюється з утворенням Pb.
Заряджений акумулятор можна зараз же використовувати, як гальванічний елемент. Схема його така:
(–) Pb0 H2SO4 H2SO4 PbO2 (+)
Під час розрядки акумулятора на електродах проходять відповідні оборотні процеси і хімічна енергія перетворюється на електричну:
А (+): Pb0 + SO42– 2ē PbSO4
 K
(–): PbO2
+ 4H+
+ SO42-
+ 2ē
PbSO4
+ 2H2O
K
(–): PbO2
+ 4H+
+ SO42-
+ 2ē
PbSO4
+ 2H2O
PbO2 + Pb0 + 2H2SO4 2PbSO4 + 2H2O
Його ЕРС відрізняється стабільністю і дорівнює 2,001 В. Промисловий акумулятор для автомобілей складається з шости таких вічок і його ЕРС дорівнює 12 В.Ступінь розрядження акумулятора визначають за зменшенням густини кислоти, оскільки її концентрація внаслідок утворення PbSO4 зменшується. При зменшенні ЕРС до 1,85 В акумулятор заряджають знову.
Ці акумулятори дуже широко використовуються у промисловості ( 90 % від загальної кількості вироблених пристроїв).
Рафінування металів
Рафінування металів – це процес очищення їх за допомогою електролізу. Розглянемо процес рафінування міді. Анодами є пластини забрудненої (чорнової) міді товщиною 25...50 мм, які електрохімічно розчинюються разом з домішками – активними та неактивними металами. Катодами є листи рафінованої міді товщиною 0,5...0,7 мм. Електроліт складається з розчину мідного купоросу і сульфатної кислоти, температура в електролізері 50...60 С. Умови електролізу підбирають таким чином, щоб на катоді з електроліту осаждувалася тільки мідь, а домішки залишалися у розчині ( Fe2+, Zn2+, Ni2+), або випадали у осад (Ag, Au, Se). Метали, потенціали яких є близькими до потенціалу міді осаджуються разом з нею на катоді ( As, Bi, Pb, Sn).
(-) Сu (чорнова ) CuSO4 Cu (очищена ) (+)
А: Cu0 2ē Cu 2+
K: Cu2+ + 2ē Cu0
Таким чином добувають мідь досить високого ступеню чистоти ( > 99,0% Cu)
Добування газів, лугів, активних металів
О2 і Н2 добувають при електролізі води, розчинів лугів і кислот, Сl2 – при електролізі розплавів і розчинів солей лужних металів. Лужні і лужноземельні метали добувають електролізом розплавів солей (схеми процесів наведені вище).
Добування алюмінію. Алюміній добувають електролізом розплавленої суміші глинозему і криоліту (Al2O3 + Na3[AlF6]) при температурі 1000 оС. Криоліт додають для підвищення електропровідності розплаву і зниження температури плавлення Al2O3. Глинозем при цій температурі дисоціює на іони:
Al2O3 Al 3+ + AlO3 3–
Анодом є товсті графітові стрежні, катодом – залізний корпус ванни, футеро-ваний графітом. Електродні процеси такі:
А: 4AlO3 3- – 12 ē 2Al2O3 + 3O2
K: Al3+ + 3e Al0.
Гальванопластика і гальваностегія
Гальванопластика – процес виготовлення точних копій виробів з металів, пластмас шляхом нанесення електрохімічного покриття, яке легко відокремлюється від основи. Гальванопластика широко застосовується при виготовленні матриць у поліграфії, пресформ і т.п. Цим методом виробляють фольгу, ювелірні вироби, копії скульптур, гравюр, деталі машин складної конфігурації. Товщина осадженого металу коливається в межах 0,1...10,0 мм.
Гальваностегія – процес нанесення металевого покриття на метали шляхом електролізу. В основному ці покриття наносяться з декоративною метою та з метою захисту металів від корозії і будуть розглядатися у відповідному розділі. Основна різниця обох процесів складається у тому, що у гальванопластиці покриття відокремлюють від основи, а у гальваностегії покриття повинно міцно зєднатися з основою.
