
- •Розділ 6. Окиснювально–відновні процеси і елементи електрохімії
- •6.1 Окиснювально–відновні процеси
- •Питання і задачі
- •Сформулюйте поняття «відновник». Наведіть приклади типових відновників.
- •6.2. Електроди і електродні реакції
- •6.3. Гальванічні елементи
- •Питання і задачі
- •6.4. Електроліз
- •Питання і задачі
- •6.5. Корозія металів
- •Питання і задачі
6.3. Гальванічні елементи
Окислювально-відновна реакція може відбуватися хімічним шляхом -коли електрони від відновника безпосередньо переходять до окиснювача. Енергія хімічної реакції в цьому процесі перетворюється на теплову.
Якщо окиснювально-відновні процеси просторово відокремити, що відбувається у гальванічних елементах, перехід електронів від відновника до окиснювача спричинює виникнення електричного струму та перетворення хімічної енергії у електричну.
Гальванічним елементом називається пристрій для перетворення хімічної енергії окиснювально-відновної реакції у електричну енергію.
Він складається з двох електродів, електрохімічно з¢єднаних між собою. Вони утворюють електричне коло - зовнішнє та внутрішнє. До зовнішнього кола відносяться електричні проводи та електричні прилади (вимірювачі величини струму і напруги, джерело струму, тощо). Внутрішнє коло складається з електродів, причому електроліти з¢єднуються між собою напівпроникною мембраною або електролітичним містком. Електролітичний місток складається з скляної або пластмасової трубочки, заповненою насиченим розчином КСl і з обох кінців закритою азбестовим гнітом.
У гальванічному елементі, потенціали електродів якого не дорівнюють один одному, процеси на електродах не будуть рівноважними. На одному з них, більш активному, обов¢язково йде процес окиснення, на іншому (менш активному) - процес відновлення. Окиснювальна форма речовини (позначається Ох) завжди має більшу алгебраїчну величину заряду, ніж відновна (позначається Red).
Катод - це електрод, на якому відновлюються катіони або нейтральні молекули: Ох + nе Red.
 4
4
V
 3
3
1 2
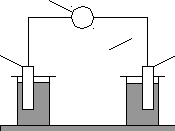
Рис.... Схема гальванічного елемента (елемент ЯкобіДаніеля).
1 цинковий електрод, занурений у розчин цинк сульфату; 2 мідний електрод, занурений у розчин купрум сульфату; 3 електролітичний місток; 4 вольтметр
 2Н+
+ē®
Н2
2Н+
+ē®
Н2
Сu 2+ + 2ē ® Cu0 - приклади катодних реакцій.
4H2O + 2ē ® H2 + 2OH-
Анод - це електрод, на якому окиснюються катіони, аніони та нейтральні молекули: Red ne Ox.
 Fe2+
-
1ē ®
Fe3+
Fe2+
-
1ē ®
Fe3+
4OH- - 4ē® O2 + H2O - приклади анодних реакцій.
Zn0 - 2ē ® Zn2+
Катод – це завжди інертний електрод, на якому є надлишок електронів і які він віддає частинкам електроліту.
Анод може бути інертним (неактивним) або активним. Інертний анод має достатньо велике значення електродного потенціалу (ними можуть бути, як правило, благородні метали та графіт) і тільки приймає на себе електрони від частинок електроліту, тобто служить для їх накопичення. Активний анод сам розчинюється і посилає катіони у розчин, тобто матеріал катоду безпосередньо приймає участь у окиснювальному процесі: Zn0 -2ē Zn2+.
Віднесення електродів до певного типу залежить від значення потенціалів обох електродів: кат завжди більше, ніж ан. Наприклад, в елементі ЯкобіДаніеля анодом буде цинк, а катодом мідь. Схема цього елемента буде така:
(–)ZnZnSO4CuSO4Cu (+).
Якщо необхідно, вказують і концентраціїї електролітів, наприклад:
(–)ZnZnSO4, 1 М CuSO4, 0,1 М Cu (+).
Найголовнішою характеристикою гальванічного елемента є його електрорушійна сила ЕРС (Е), яка дорівнює різниці потенціалів катода та анода, коли вони розімкнуті, тобто, якщо гальванічний елемент знаходиться у оборотному стані.
Е = кат ан .
ЕРС завжди позитивна величина, тому що кат > ан.
Термодинаміка гальванічного елемента
Незалежно від того, за яким шляхом, хімічним або електрохімічним, відбувається реакція, енергетичні зміни у системі однакові. З курсу термодинаміки відомо, що максимальна робота виконується системою у рівноважному стані, тобто коли система є оборотною.
Гальванічний елемент є оборотним, якщо виконуються дві умови.
1. Він складається з оборотних електродів;
2. До нього підключено зовнішнє джерело електричного струму, ЕРС якого має протилежний напрямок і на нескінченно малу величину відрізняється від ЕРС самого елемента. При цих умовах
-DG0=А макс =nEF,
де n - кількість електронів у сумарній електродній реакції; Е - ЕРС гальва-нічного елемента, В; F - число Фарадея - кількість електрики, яку переносить один еквівалент електронів; F = e . NА, Кл / моль
З другого боку зміна енергії Гіббса повязана з константою хімічної рівноваги рівнянням G0 = – RT . ln K. , де К константа рівноваги відповідної окиснюваль-ної реакції і дорівнює добутку рівноважних концентрації продуктів, поділеному на добуток рівноважних концентрацій вихідних речовин з урахуванням стехіометричних коефіцієнтів. Виходячи з цих рівнянь Нернст довів формулу для розрахунку потенціалів електродів в залежності від концентрацій окиснювальної і відновної форм речовини.
Нехай на електроді у загальному вигляді відбувається реакція
aRed ne bOx
Для цього процесу рівняння Нернста має вигляд:
=
0
RT/nF
.ln
![]() ,
,
де 0 – стандартний електродний потенціал ( див. наступний розділ). 2,3.RT/F = = 0,059 (2,3 - основа натурального логарифму), тому для температури 298 К рівняння можна спростити
=
0
+ 0,059 / n
lg![]()
Експериментальне визначення електродних потенціалів
Для визначення електродних потенціалів збирають гальванічний елемент з стандартного водневого електрода і дослідженого електрода.
Водневий електрод – це платинова пластина, що покрита губчастою платиною (інертний електрод), яка насичена газоподібним воднем. Він подається під тиском 101,3 кПа у розчин сульфатної або хлоридної кислоти з концентрацією (точніше, активністю) СН+= 1моль/л, у який занурена платинова пластина. Схема електроду така: Pt, 2H+ çH2
(Спочатку вказується матеріал електроду, окиснена форма речовини і через риску – відновлена форма речовини). На електроді відбуваються пряма чи зворотна реакції, в залежності від того, катодом чи анодом буде водневий електрод в парі з дослідженим електродом:
К: 2Н+ + 2ē ® Н2
А: Н2 - 2ē ® 2Н+
За тиском водню Р =101,3 кПа і СН+ = 1моль/л потенціал цього електроду при температурі 298 К умовно прийнято за нуль і відносно цього електроду визначаються потенціали усіх інших електродів.
При РН2 = 101,3 кПа та інших значеннях концентрації (активності) водню потен-ціал водневого електрода, виходячи з рівняння Нернста, розраховується за формулою
(2Н+Н2) = - 0,059 рН.
Приклад 1. Розрахувати потенціал водневого електрода з концентрацією [Н+] = 10-3 М.
Розязання:
рН ?
рН = – lg[Н+] = – lg10-3 = 3.
2. (2Н+Н2) ?
2Н+Н2 = - 0,059 рН = 0,059 .3 = – 0,0177 В.
Відповідь: потенціал водневого електроду при рН = 3 дорівнює – 0,0177 В.
Після збирання гальванічного елемента, вимірюють його ЕРС і розраховують потенціал дослідженого електрода. Наведемо приклади цього визначення. Нехай є електрод, утворений активним металом, який у парі з водневим електродом буде анодом, тобто буде розчинятися. Схема його буде така:
() Ме Меn+ 2Н+Н2, Pt (+).
А: Ме nē Ме n+
К : 2Н+ + 2ē Н20
ЕРС = кат ан = ан, кат = 0, а ЕРС завжди позитивна, тому знак потен-ціалу аноду повинен бути відємним.
Якщо в парі з водневим електродом буде електрод, утворений малоактивним металом, в даному випадку він буде катодом. Схема цього гальванічного елемента така:
() Pt, H2 2H+ Men+ Me (+)
А: Н2 2ē 2Н+
К: Меn+ + nē Ме0
ЕРС = кат 0ан = кат
Отже, електродний потенциіал чисельно дорівнює ЕРС гальванічного елемента, складеного з стандартного водневого електрода і досліджуваного електрода, яка виміряна за стандартних умов. Він позначається (ел.) або Е(ел.).
Стандартним електродним потенціалом називається потенціал електрода при активності іонів у електроліті, які беруть участь у електрохімічній реакції, рівній одиниці. Він позначається j0(ел) або Е0(ел). Наприклад:
0 2Н+çН20 = 0,00 В ; j0 Zn2+çZn0 = - 0,76 В.
Всі стандартні потенціали зведені у таблиці, а самі метали утворюють так званий ряд активності металів (або ряд напруг металів). Природно, що у цьому ряду присутній водень, тому що відносно його потенціалу визначаються усі інші потенціали.
Li K Ba Ca Na Mg Al Ti Mn Zn Cr Fe Cd Co Ni Sn Pb H2 Bi Cu Ag Au
Метали, активніши за водень мають від¢ємний знак потенціалу, тому що в парі з водневим електродом є анодами. Малоактивні метали, які розташовані в ряді активності металів після водню, мають додатний знак потенціалу, тому що в парі з водневим електродом грають роль катодів. Наприклад,
j0Fe2+çFe0 = - 0,44 В, j0 Cu2+çCu0 = + 0,34 В.
При концентраціях електролітів, не рівних одиниці для розрахунку електродних потернціалів використовують рівняння Нернста.
Приклад 2. Розрахувати потенціал залізного електрода, зануреного у 0,1 М розчин ферум)ІІ) хлориду.
Розвязання:
Для розрахунку потенціалу в таблиці знаходимо значення стандартного потенціалу ( 0Fe+2Fe0 = – 0,44 В) і використовуємо формулу Нернста:
Fe+2Fe0 = 0Fe+2Fe0 + 0,059 / 2 lg C( Fe+2) = 0,44 + 0,059/2 lg10-1 = 0,44 0,03 = 0,47 В.
Відповідь: потенціал залізного електрода дорівнює 0,47 В.
Крім металевих і газових електродів, до яких відноситься водневий електрод існують окиснювально-відновні електроди (або редокс-електроди). До них належать напівелементи, які складаються з інертного металу (платина, золото), зануреного у розчин, в якому містяться окиснена та відновлена форма однієї і тієї ж речовини. Наприклад:
Pt ,Fe3+çFe2+ ; Fe3+ + e ® Fe2+
Pt, Mn7+çMn2+; Mn7+ + 5ē Mn2+ або MnO4- + 8H+ + 5e ® Mn2+ + 4H2O, (в таблицях пишуться не електронні, а електронно-іонні рівняння)
Атоми платини не беруть участь у електродному процесі, а є тільки переносниками електронів. Величина електродного потенціалу залежить від концентрацій окиснювальної та відновної форм речовини
jOх
çRed
= j0Oх
çRed
+
![]() lg
lg![]()
Наприклад,
jFe3+çFe2+
= j0
Fe3+çFe2+
+
![]() lg
lg![]() ;
;
j
Мn+7çMn2+
= j0Мn+7çMn2+
+
![]() lg
lg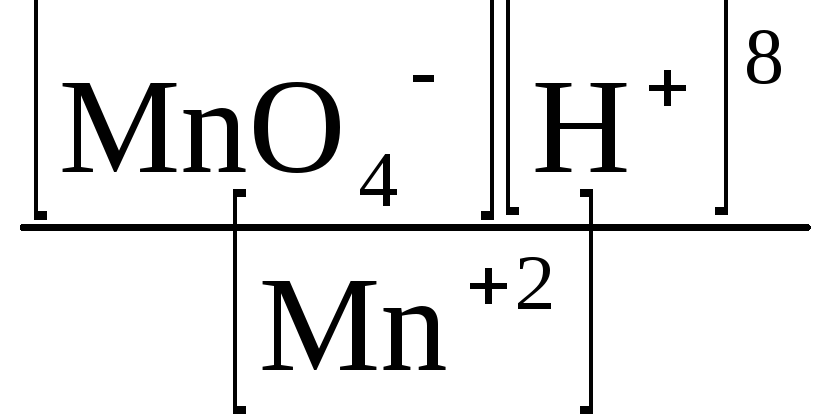 .
.
Cтандартні окиснювально-відновні потенціали зведені у таблиці і також визначаються за водневою шкалою, тобто порівнюються з потенціалом стандартного водневого електрода. Вони характеризують здатність системи функцінувати в якості окиснювача або відновника. Чим позитивніше значення ОВ-потенціалу, тим сильнішим окиснювачем є система. Знак "-" означає, що самодовільно відбувається процес окиснення, знак "+" - процес відновлення.
Наприклад:
електрод електродні процеси j , В самодовільний процес
Pt,Cr+3 çCr+2 Cr+3 + 1e « Cr+2 -0,41 Cr+2 - 1e ® Cr+3
Pt,Sn+4 çSn+2 Sn+4 + 2e « Sn+ +0,15 Sn+4 + 2e ® Sn+2
Приклад 3. Розрахувати потенціал окиснювально відновного манганового електрода, якщо концентрації перманганат-іона та іона Mn+2 дорівнюють одиниці, а рН розчину 3.
Розвязання:
1.jМnO4-+8H+çMn2++4H2O ?
Використовуємо значення стандартного потенціалу, взятого з таблиць і рівняння Нернста для окиснювальновідновних електродів.
j0МnO4-+8H+çMn2++4H2O = 1,55 В.
jМnO4-+8H+çMn2++4H2
=
j0МnO4-+8H+çMn2++4H2O
+![]() lg
lg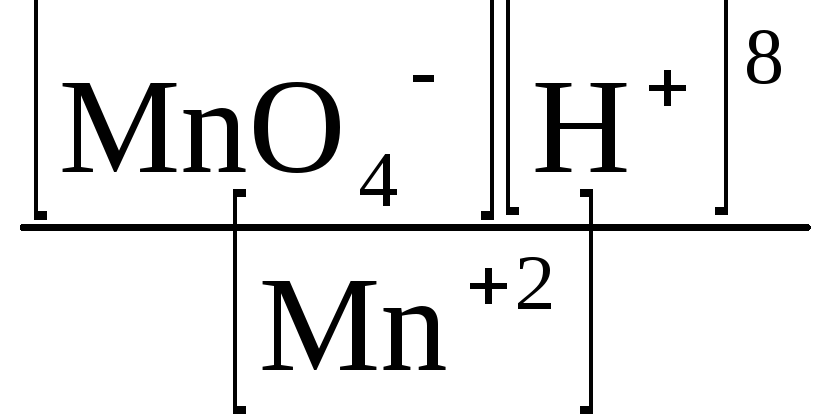 =
=
=
1,55 +
![]() lg
lg![]() =
1,55 +
=
1,55 +
![]() lg
10-24
=
1,55
0,28 = 1,27 В.
lg
10-24
=
1,55
0,28 = 1,27 В.
Відповідь: потенціал манганового електрода у розчині з рН 3 дорівнює 1,27 В.
Використання розрахунку ЕРС для окислювально-відновних кіл дає можливість визначити напрямок окислювально-відновної реакції незалежно від того, хімічним, або електрохімічним шляхом вона йде. Ввжається, що відновна реакція відповідає анодному процесу , а окислювальна реакція – катодному. Тоді
ЕРС = jкат - jан = jокис - jвід > O.
Приклад наведений в темі «Окиснювально-відновні реакції».
Типи гальванічних елементів та їх розрахунки
Гальванічні елементи поділяють на хімічні та концентраційні. У хімічних колах рушійною силою процесу та джерелом електричної енергії є хімічна реакція. Їх ЕРС залежить від хімічної природи речовин і їх активностей у розчині. Прикладами хімічних кіл є системи з металевих електродів, акумулятори. Концентраційні елементи складаються з електродів однакової хімічної природи, які відрізняються один від другого лише концентрацією розчинів. Рушійною силою процесу та джерелом електричної енергії є вирівнювання концентрацій речовин у електролітах обох електродів, яке відбувається, в першу чергу, електрохімічним шляхом, а не за рахунок дифузії. Як тільки концентрації іонів у електролітах стануть дорівнювати одна одній, гальванічний елемент перестає діяти і його ЕРС = 0. На електродах відбувається одна й та ж реакція, але у різних напрямках, тобто відбувається перенос речовини з одного електрода на другий:
Прикладом може бути такий елемент
(-) Ag ç AgNO3,С1 çç AgNO3 , С2ç Ag (+); С1 < С2 .
На першому електроді - аноді, де концентрація електроліту нижче, метал розчинюється і його катіони переходять у розчин. На другому електроді – катоді, де концентрація електроліту вище, катіони металу будуть осаджуватися
А: Ag0 - 1ē Ag+, С1
K: Ag+ +1ē Ag0 , С2
Сумарна реакція має вигляд : Ag0 - 1ē « Ag+
ЕРС = jкат - jан = j0 + 0,059 lg С2 - j0 - 0,059 lg С1 = 0,059lg(С2/С1)
Ця формула використовується для розрахунку ЕРС у концентраційних колах.
Для розрахунку гальванічних елементів необхідно:
Розрахувати значення потенціалів обох електродів;
Визначити катод і анод;
Записати схему гальванічного елемента і вказати напрямок електричного струму;
Записати електродні процеси;
Розрахувати ЕРС елемента;
Розрахувати DG та А макс.
Приклад 4. Розрахувати гальванічний елемент, складений з цинкової пластини, зануреної у розчин цинк сульфату з концентрацією 10-3 моль/л та залізної пластини, зануреної у розчин ферум хлориду з концентрацією 10-1 моль/л.
Розв¢язання:
Zn2+Zn, Fe2+Fe ?
В таблиці стандартних потенціалів знайдемо значення стандартних електродних потенціалів систем Zn2+Zn0 та Fe2+Fe0 і розрахуємо потенціали окремих електродів за рівнянням Нернста.
0Zn2+Zn0 == 0,76 B, j0Fe2+Fe0 = 0,44 B.
Zn2+Zn0 = 0Zn2+Zn0 + (0,059 / 2) lg С(Zn2+) = 0,76 + (0,059 / 2) lg 10-3 =
= 0,76 + ( 0,09) = 0,85 В.
Fe2+Fe0 = 0Fe2+Fe0 + (0,059 / 2 ) lg С(Fe2+) = 0,44 + (0,059 / 2) lg 0,1 =
= 0,44 + 0,03 (1) = 0,47 В.
2.Визначення катода і анода.

 0,85
В
0,47 В
0,85
В
0,47 В
 А
К
А
К
Цинковий електрод буде анодом, оскількі має більш відємний потенціал, залізний електрод буде катодом (більша алгебраїчна величина потенціалу).



 3.
Схема гальванічного елемента і напрямок
електричного струму.
3.
Схема гальванічного елемента і напрямок
електричного струму.
() Zn |Zn(NO3)2 (10-3 М) Fe(NO3)2 (0,1 М )| Fe (+).
4. Електродні процеси.
А: Zn0 2е Zn2+ ;
на цинковому електроді відбувається процес окиснення цинка.
К: Fe2+ + 2e = Fe0;
на залізному електроді відбувається відновлення заліза.
5. ЕРС ?
Е = Fe2+Fe0 Zn2+Zn0 = 0,47 – (0,85) = 0,38 В.
6. DG0 ?
DG0 = – Аmах –nEF = – 2 0,38 96500 = – 73340 Дж/моль
Відповідь: ЕРС елемента дорівнює 0,38 В, DG0 = – 73340 Дж/моль.
