
- •Розділ 6. Окиснювально–відновні процеси і елементи електрохімії
- •6.1 Окиснювально–відновні процеси
- •Питання і задачі
- •Сформулюйте поняття «відновник». Наведіть приклади типових відновників.
- •6.2. Електроди і електродні реакції
- •6.3. Гальванічні елементи
- •Питання і задачі
- •6.4. Електроліз
- •Питання і задачі
- •6.5. Корозія металів
- •Питання і задачі
Питання і задачі
Сформулюйте поняття «ступінь окиснення» Як визначити ступінь окиснення елемента у сполуках ?
Визначте ступінь окиснення елементів у наведених сполуках: Na2SO4, KМnO4, MnO2, K2Cr2O7, H3PO4, MoO3, Na2S2O3, K4[Fe(CN)6], Na3[AlF6].
Сформулюйте поняття «окиснювач». Наведіть приклади типових окиснювачів.
Сформулюйте поняття «відновник». Наведіть приклади типових відновників.
Чи можливо розчин ферум (ІІ) сульфату зберігати у нікелевій посудині?
Що буде відбуватися, якщо розчин ферум (ІІ) нітрату перемішувати алюмінієвою ложкою?
Розставити коефіцієнти у окиснювально-відновних реакціях:
Cu + HNO3 Cu(NO3 )2 + NO2 + H2O
KMnO4 + H2SO4 + KI MnSO4 + I2 + K2SO4 + H2O
K2Cr2O7 + H2S + H2SO4 Cr2(SO4)3 + K2SO4 + S +H2O
8. Визначити напрямок окиснювально-відновного процесу:
Cr2(SO4)3 + I2 + H2O K2Cr2O7 + H2SO4 + KI
FeCl3+ Na2SO3 + H2OFeCl2+ Na2SO4+ HCl
6.2. Електроди і електродні реакції
Загальні поняття про електрохімічні реакції та електродні потенціали
Електрод – це двохфазна система, яка складається з провідника першого роду, зануреного у електроліт (провідник другого роду). У провідниках першого роду (метали, графіт) електричний струм виникає завдяки руху електронів, у електролітах – завдяки руху іонів, причому електрони не можуть рухатись у електролітах, а іони – у металах, тому на поверхні розділу фаз у електрода відбуваються реакції особливого типу.
Електрохімічні реакції – це процеси обміну електронами між провідниками першого роду і частинками електроліту – іонами та молекулами.
У металах і графіті у вузлах кристалічної решітки знаходяться катіони, між якими відносно вільно рухаються електрони, причому кількість позитивних зарядів іонів металів дорівнює кількості електронів. Якщо провідник першого роду занурити у електроліт, виникає перерозподіл позитивних та негативних зарядів (іонів, електронів, диполів), причому одна з фаз завжди заряджується позитивно, друга – негативно. Це спричинює виникненню на межі поділу двох фаз подвійного електричного шару, що в свою чергу зумовлює появлення стрибка потенціалу, або просто потенціалу.
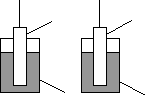 Розглянемо
два випадки цих процесів, звертаючи
увагу на те, що у розчинах іони завжди
сольватовані і характеризуються певною
енергією сольватації -Есольв
(для
води -
енергією гідратації (Егідр).
У провідниках першого роду міцність
зв¢язку
між іонами характеризується енергією
кристалічної решітки - Ек.р.
Розглянемо
два випадки цих процесів, звертаючи
увагу на те, що у розчинах іони завжди
сольватовані і характеризуються певною
енергією сольватації -Есольв
(для
води -
енергією гідратації (Егідр).
У провідниках першого роду міцність
зв¢язку
між іонами характеризується енергією
кристалічної решітки - Ек.р.
А 1 В 2
+ - - + - + + -
+ - - + - + + -
+ - - + - + + -
+ - - + - + + -
+ - - + - + + -
3 3
Рис. 5. Перерозподіл зарядів біля поверхні розділу фаз. А- електрод з активного металу (1) і В - електрод з неактивного металу (2), занурені у розчини електролітів 3.
У випадку активних металів (Zn, Fe, Ni) Е кр.р.< Е гідр., тому катіони переходять у розчин, гідратуються і групуються біля поверхні розділу фаз, яка заряджується негативно тому, що на неї утворюється надлишок електронів.
У випадку неактивних металів (Cu, Ag) Е кр.р.>Егідр., тому катіони не можуть переходити у розчин (точніше, вони переходять у незначних кількостях), але якщо у розчині є іони металів, з яких складається тверда фаза, катіони з розчину починають добудовувати кристалічну решітку і тверда фаза заряджується позитивно внаслідок надлишку катіонів. Біля поверхні розділу групуються аніони з розчину.
У обох випадках утворюється подвійний електричний шар (ПЕШ), який спричинює виникненню стрибка потенціалу. Процес перерозподілу заряджених частинок - самодовільний, DG < О. Він йде у електрохімічній системі до досягнення нею стану рівноваги, коли кількість іонів, які переходять у розчин, буде дорівнювати кількості іонів, які осаджуються на поверхні твердої фази (DG0 = О). Потенціал при DG0 = О називається рівноважним. Потенціали поз-начаються літерами Е(ел) або j(ел). Будова ПЕШ та величина потенціалу залежать від природи та складу розчину електроліту, природи, стану поверхні електроду та зовнішніх умов.
Електроди можуть бути оборотними та необоротними. Оборотні - це такі еле-ктроди, на яких відбуваються оборотні реакції (пряма – самодовільна, зворотна – при накладенні протилежно направленої зовнішньої напруги). Наприклад: цинк, занурений у розчин своєї солі:
Zn0 « Zn+2 + 2ē
Необоротні – це таки електроди, на яких у прямому напрямку відбувається одна реакція, у протилежному (при накладенні зовнішньої напруги) – інша. Наприклад: цинк, занурений у розчин сульфатної кислоти:
пряма реакція Zn0 -2ē ® Zn+2;
зворотна реакція 2Н+ + 2ē ® Н2.
Безпосереднє вимірювання електродних потенціалів неможливо, але можливо вимірювати різницю потенціалів між двома електродами, якщо прийняти один електрод за електрод порівняння.
