
- •Методичні вказівки для підготовки до лабораторних робіт з курсу хімії
- •Окиснювальна форма Число отриманих Відновна форма0, в
- •Додаток 3.Порядоквизначення напрямку окиснювально-відновних реакцій
- •Порівняти окиснювальні властивості іонів MnO4– та Сr2o72–у кислому середовищі.
- •Лабораторна робота № 2 гальванічні елементи
- •Лабораторна робота № 3 електроліз розчинів солей
- •Лабораторна робота № 4
- •V Рис.4. Схема гальванічного елемента:
- •Лабораторна робота № 5 захист металів від корозії
- •Лабораторна робота № 7
- •Розділ IV. Комплексні сполуки d-елементів
- •Експериментальна частина. Розділ іі
Лабораторна робота № 4
КОРОЗІЯ МЕТАЛІВ
Мета роботи: вивчення причин виникнення мікрогальванопар на поверхні кородуючого металу; визначення стаціонарних потенціалів корозійних процесів.
Дослід 1. Утворення мікрогальванопар на цинку та залізі у кислому середовищі в присутності солі Купруму
1. Шматочок гранульованого цинку помістити в пробірку і долити 2-3 мл розведеної сульфатної кислоти. Спостерігати розчинення цинку і поступове виділення водню за реакцією:
Zn0 + 2H+ Zn+2 + H20.
Долити декілька крапель розчину купрум сульфату і спостерігати збільшення швидкості виділення водню внаслідок виникнення мікрогальванічних елементів на поверхні цинку, в яких цинк є анодом, а мідь катодом:
(–) Zn | H2SO4 | H2, (Cu) (+).
Анод окиснюється (розчинюється):
А: Zn0 – 2ē Zn+2.
На катоді відбувається воднева деполяризація (процес відновлення):
К: (Cu) 2H+ + 2ē 2H0; 2H0 H2 .
2. Зробити аналогічний дослід зі шматочком заліза. Записати схему утворено-го корозійного елемента, визначити катод і анод. Записати процеси, які відбува-ються на електродах корозійного гальванічного елемента.
Дослід 2. Корозія внаслідок нерівномірного доступу кисню (диференційної аерації).
На рис.3 зображено поверхню металу, вкритого краплею вологи.
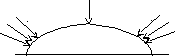 О2
О2
О2 О2
К А К
Рис.3. Схема диференційної аерації
Стальну пластинку ретельно зачистити наждачним папером, промити і висушити фільтрувальним папером. На чисту поверхню нанести 12 краплі 3%-го розчину натрій хлориду. У центр цієї краплі додати краплю червоної кровяної солі К3[Fe(CN)6], на край краплі – фенолфталеїну.
Внаслідок нерівномірного доступу кисню утворюється корозійний гальванічний елемент
(–)Fe, Fe2+ | H2O, O2(C1) | H2O, O2(C2) | OH–, Fe (+) , C2 > C1, або
(–)Fe, Fe2+ | H2O, O2 | OH–, Fe (+)
Записати катодні а анодні процеси в ньому.
Спостерігати появу синього забарвлення в центрі краплі і рожевого по краях і пояснити ці явища. Записати реакцію, яка підтверджує наявність анодної ділянки
у центрі краплі.
Дослід 3. Активатори корозії
Іони, які руйнують захисні плівки металів і тим самим сприяють корозії, називаються активаторами корозії. У морській воді активаторами є іони хлору.
Помістити в дві пробірки по шматочку або гранулі алюмінію і долити до нього розчин купрум сульфату, трохи підкисленого сульфатною кислотою. В одну з пробірок долити декілька крапель розчину NaCl.
Спостерігати корозію (розчинення) алюмінію в пробірці з NaCl. Пояснити результати досліду, записати схему корозійного гальванічного елемента і реакції на катоді і аноді.
Дослід 4. Визначення стаціонарного потенціалу металу в морській воді
Для визначення стаціонарного потенціалу металу в морській воді зібрати гальванічний елемент, який складається з зразка досліджуваного металу і електрода порівняння (рис.4.)
