
- •Методичні вказівки для підготовки до лабораторних робіт з курсу хімії
- •Окиснювальна форма Число отриманих Відновна форма0, в
- •Додаток 3.Порядоквизначення напрямку окиснювально-відновних реакцій
- •Порівняти окиснювальні властивості іонів MnO4– та Сr2o72–у кислому середовищі.
- •Лабораторна робота № 2 гальванічні елементи
- •Лабораторна робота № 3 електроліз розчинів солей
- •Лабораторна робота № 4
- •V Рис.4. Схема гальванічного елемента:
- •Лабораторна робота № 5 захист металів від корозії
- •Лабораторна робота № 7
- •Розділ IV. Комплексні сполуки d-елементів
- •Експериментальна частина. Розділ іі
Додаток 3.Порядоквизначення напрямку окиснювально-відновних реакцій
Відомо, що напрямок перебігу процесів визначається з умови G0реак < О. Для окиснювально-відновних процесівG0реакрозраховується за формулою
G0реак = n E F,
де n – кількість електронів у сумарному молекулярно-іонному рівнянні окис-нювально-відновного процесу; Е – електрорушійна сила (ЕРС) гальванічного елемента, утвореного електродами, на яких відбуваються окиснювальні та відновні процеси; F – число Фарадея, 96500 Кл/моль.
Для виконання цієї умови необхідно, щоб ЕРС була позитивною. ЕРС гальванічного елемента розраховується за формулою:
Е = 0окис – 0відн.
Значення стандартних потенціалів окиснювально-відновних реакцій знаходять у таблицях. Потенціал окиснювача завжди більше потенціалу відновника. Чим більш позитивне значення потенціалу, тим сильнішим окиснювачом є система.
Приклад 1. Визначити напрямок перебігу окиснювально-відновної реакції:
2KMnO4 + 8H2SO4 + 10KI 2MnSO4 + 6K2SO4 + I2 + 8H2O.
Розвязання:
1. Визначення за таблицею (див. додат.1) стандартних значень окиснювально-відновних напівреакцій:
 MnO4–
+
8H+
+ 5ē
Mn+2
+ 4H2O;
0
=
+ 1,51 В,
MnO4–
+
8H+
+ 5ē
Mn+2
+ 4H2O;
0
=
+ 1,51 В,
I20 + 2ē 2I–; 0 = 0,52 В.
Із значень стандартних потенціалів напівреакцій визначаємо, що MnO4– – окиснювач , I– – відновник, тобто, напівреакції мають напрямок:
MnO4– + 8H+ + 5ē Mn+2 + 4H2O
2I– – 2ē I20.
Е = окис – відн = 1,51 – 0,52 = 0,99 В.
G0реак = nEF = 10 . 0,99 . 96500 = 955350 Дж/моль. Реакція відбувається у напрямку зліва направо:
2KMnO4 + 8H2SO4 + 10KI 2MnSO4 + 6K2SO4 + I2 + 8H2O.
Приклад 2. Визначити напрямок перебігу окиснювально-відновної реакції:
Cr2(SO4)3 + 3Fe2(SO4 )3 + K2SO4 +7H2O К2Сr2O7 + 6FeSO4 + 7H2SO4 .
Порівняти окиснювальні властивості іонів MnO4– та Сr2o72–у кислому середовищі.
Розвязання:
Визначення за таблицею (див. додат. 1) стандартних потенціалів напівреакцій.
Сr2O72– + 14H+ + 6ēCr+3+7H2O;0= 1,36 В.
2Fe+3 + 2ē 2Fe+2 ; 0 = 0,77 В.
Із значень стандартних потенціалів напівреакцій визначаємо, що Сr2O72– окис-ник, Fe+2 – відновник, тобто напівреакції мають напрямок:
Сr2O72– + 14H+ + 6ē Cr+3 +7H2O;
2Fe+2 – 2ē 2Fe+3;
Е = окис – відн = 1,36 – 0,77 = 0,79 (В).
G0реак = nEF = 6 . 0,79 . 96500 = 457410 Дж/моль. Реакція відбувається з права наліво.
К2Сr2O7 + 6FeSO4 + 7H2SO4 Cr2(SO4)3 + 3Fe2(SO4 )3 + K2SO4 +7H2O.
2. Порівняння окиснювальних властивостей іонів MnO4– та Сr2O72– у кислому середовищі.
Іон MnO4– більш сильний окиснювач, ніж Сr2O72–, тому що стандартний потенціал напівреакції відновлення MnO4– (1,51 В) більший, ніж стандартний потенціал напівреакції відновлення Сr2O72– (1,36 В).
Лабораторна робота № 2 гальванічні елементи
Мета роботи: придбання навичок розрахунків гальванічних елементів; ознайомлення з процесами, які проходять при їх роботі; вимірювання різниці потенціалів на електродах гальванічного елемента.
Робота виконується в два етапи. Перший – теоретичне обгрунтування даної роботи шляхом розрахунків гальванічних елементів. Другий практичне ознайом-лення з процесами. які відбуваються при роботі гальванічних елементів.
І. Розрахунок гальванічних елементів.
Приклад розрахунку гальванічних елементів.
Розрахувати гальванічний елемент, який складається із залізного електрода,
зануреного у 0,01 М розчин FeSO4 і нікелевого електрода, зануреного у 0,1 М розчин NiCl2.
Визначення катода і анода у гальванічному елементі.
За таблицею знаходимо значення стандартних електродних потенціалів і розраховуємо потенціали електродів згідно з рівнянням Нернста:
0Fe+2Fe = –0,44 В, 0Ni+2Ni = –0,25 В ;
Fe+2Fe=
0Fe+2Fe
+
![]() [Fe+2]
=
0,44
+
[Fe+2]
=
0,44
+
![]() =0,44
– 0,059 = 0,50
В.
=0,44
– 0,059 = 0,50
В.
Ni+2Ni
=
0Ni+2Ni
+
![]() [Ni+2]
=
0,25
+
[Ni+2]
=
0,25
+
![]() =0,25
– 0,03 = 0,28
В.
=0,25
– 0,03 = 0,28
В.
Потенціал нікелевого анода має більшу алгебраїчну величину, тому у даній парі він буде катодом, а залізний електрод – анодом.
Складання схеми гальванічного елемента:
() Fe FeSO4, 0,01 M NiCl2, 0,1 M Ni (+).
Запис електродних процесів:
А: Fe0 – 2ē Fe+2
K :
Ni+2
+ 2ē
Ni0
:
Ni+2
+ 2ē
Ni0
Fe0 + Ni+2 Fe+2 + Ni0 сумарний процес у гальванічному елементі.
Визначення електрорушійної сили (ЕРС, Е) гальванічного елемента.
Е = кат анод = Ni+2Ni – Fe+2Fe = –0,28 – (0,50) = +0,22 В.
Розрахунок зміни енергії Гіббса і максимальної роботи:
G0= – Аmах = nEF = 2 . 0,22 . 96500 = 42460 Дж.
На підставі наведеного прикладу виконати розрахунки гальванічних елементів, що складаються із:
1. Залізного електрода (залізної пластини, зануреної у 0,01 М розчин FeSO4) і мідного електрода (мідної пластини, зануреної у 0,1 М розчин CuSO4).
Цинкового електрода (цинкової пластини, зануреної у 1 М розчин ZnSO4) і мідного електрода (мідної пластини, зануреної у 1 М розчин CuSO4).
Цинкового електрода (цинкової пластини, зануреної у 1 М розчин ZnSO4) і нікелевого електрода (нікелевої пластини, зануреної у 1 М розчин NiSO4.)
Цинкового електрода (цинкової пластини, зануреної у 1 М розчин ZnSO4) і залізного електрода (залізної пластини, зануреної у 1 М розчин FeSO4.)
Залізного електрода (залізної пластини, зануреної у 1 М розчин FeSO4) і мідного електрода (мідної пластини, зануреної у 1 М розчин CuSO4).
Записи розрахунків занести до лабораторного протоколу.
ІІ. Ознайомлення з процесами, які відбуваються при роботі гальванічних елементів; вимірювання різниці потенціалів на електродах гальванічного елемента.
Для досліджень пропонуються гальванічні елементи по яких виконані розра-хунки на попередньому етапі роботи.
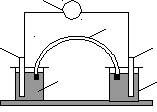 Для виконання дослідів треба
скласти гальванічний елемент згідно
зі схемою на рисунку. 1
Для виконання дослідів треба
скласти гальванічний елемент згідно
зі схемою на рисунку. 1
VРис.1. Схема гальванічного елемента:
6 1 – вольтметр; 2,3 електроди; 4, 5–
2 3 електроліти; 6 – електролітичний
ключ
4 5
Для цього слід зачистити поверхню металевих електродів і опустити їх у розчини відповідних електролітів. Два стакани з електролітами сполучити електрохімічним ключем (U-подібною трубкою, заповненою насиченим розчином КСІ). Контакти вимірювального приладу і зразків зєднати з електродами, попередньо виявити полярність за значеннями стандартних потенціалів з урахуванням схеми гальванічного елемента. Зверніть увагу на концентрації розчинів, які записані на стаканах напівелементів.
Виміряти різницю потенціалів (U) на електродах гальванічних елементів і записати ці значення у протоколі. Порівняти їх з розрахованими значеннями ЕРС. Пояснити, чому вони значно відрізняються у випадку, коли електродами є нікелеві пластини. Згадати, що це повязано з хімічною поляризацією нікелевих електродів внаслідок їх пасивації. Визначити дійсне значення потенціалу нікелевого електрода в елементі 5, використовуючи заміряний та розрахований потенціал цинкового електрода.
Результати вимірів та розрахункові значення занести до таблиці.
Т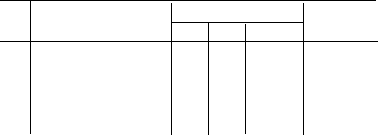 аблиця
аблиця
№ пп Схема гальванічного елемента Розрахункові значення (В) Виміряні
кат ан ЕРС значення U(В)
1
2
3
4
5
По закінчення досліджень схему розімкнути та розібрати, металеві пластини промити та висушити фільтрувальним папером.
