
- •Глава 1
- •1.3. Программные подходы в селекции лесных древесных пород
- •1.4.1. Изменчивость живых организмов
- •1.4.2. Исходный материал для селекции лесных древесных пород
- •Представленность отдельных форм у некоторых видов лиственных
- •Глава 2.
- •2.1. Виды отбора
- •2.2. Массовый отбор
- •2.2.1. Теория массового отбора и возможность его использования в лесном хозяйстве
- •2.2.2. Отбор географических происхождений, или климатипов
- •2.2.3. Отбор лучших эдафотипов
- •2.2.4. Отбор лучших (плюсовых) насаждений
- •2.2.5. Отбор лучших (плюсовых) деревьев
- •2.2.6. Отбор в питомниках и среди семян
- •2.3. Индивидуальный отбор
- •2.3.1. Метод педигри
- •2.3.2. Клоповый отбор
- •2.3.3. Индивидуальный отбор у перекрестноопыляющихся растений
- •Глава 3.
- •Пионеры в области гибридизации растений
- •3.1.1. Комбинационные скрещивания
- •3.1.2. Трансгрессивные скрещивания
- •3.1.3. Гетерозисные скрещивания
- •3.2. Методы гибридизации
- •3.3. Техника гибридизации
- •4.2. Особенности интродукции лесных древесных пород
- •4.3. Некоторые аспекты размножения
- •5.1. Общие положения по использованию
- •5.2. Экспериментальный мутагенез в селекции лесных древесных пород
- •5.2.1. Возможности и направления экспериментального мутагенеза
- •5.2.2. Физические методы получения мутантов
- •Глава 6
- •6.1.1. Особенности испытания лесных древесных пород
- •6.1.2. Генетическая оценка деревьев по их комбинационной способности
- •6.2. Понятие о селекционном и сортовом материале (термины и определения)
- •6.2.1. Селекционный улучшенный репродуктивный материал
- •6.2.2. Понятие о сорте лесных древесных растений
- •6.3.1. Задачи и виды сортоизучения и сортоиспытания
- •6.3.2. Методика сортоиспытания
- •Планируемый размер выборки в зависимости
- •От количества вариантов и значения заданной разницы 5
- •Между сравниваемыми вариантами при сортоиспытании
- •Лесных древесных пород (при измерении высот)
- •6.4. Сорторайонирование
- •Глава 7
- •7.1. Содержание лесного семеноведения
- •7.2.1. Репродуктивный цикл
- •7.2.2. Жизнеспособность семян. Методы определения качества семян
- •7.2.3. Покой семян. Хранение и способы предпосевной обработки семян
- •Глава 8
- •8.1. Термины и определения, используемые в лесном хозяйстве
- •Организация постоянной лесосеменной базы.
- •8.2. Селекционная оценка насаждений и деревьев
- •8.2.1. Отбор плюсовых деревьев
- •Некоторые показатели пд основных лесообразующих пород
- •8.2.2. Заготовка черенков и использование семян плюсовых деревьев
- •8.2.3. Отбор плюсовых насаждений
- •8.3. Лесосеменные плантации
- •8.3.1. Общая характеристика лесосеменных плантаций
- •8.3.2. Организация и освоение территории
- •8.3.4. Лесосеменные плантации повышенной генетической ценности, лсп-н
- •8.3.5. Архивы клонов и маточные плантации
- •8.3.6. Дополнение и реконструкция плантаций
- •8.4. Испытательные культуры
- •8.5. Культуры повышенной селекционной ценности
- •8.6. Постоянные и временные лесосеменные участки
- •8.7. Учет лесных селекционно-семеноводческих объектов
- •Глава 9
- •9.1. Естественное вегетативное размножение
- •9.2. Аутовегетативное размножение древесных пород
- •9.3. Гетеровегетативное размножение древесных растений
- •Глава 10 клональное микроразмножение древесных растений
- •10.1. Общая характеристика метода клонального микроразмножения
- •10.2. Организация работ по клональному микроразмножению растений
- •10.3. Питательные среды
- •Состав некоторых питательных сред (из Ahuja, 1983, концентрация вещества указана в миллиграммах на литр)
- •Условия культивирования и этапы микроразмножения
- •Глава 11
- •11.1. Селекция сосны обыкновенной
- •11.1.1. Направление селекции и сортовой идеал сосны обыкновенной
- •11.1.2. Исходный материал для селекции сосны обыкновенной
- •11.1.3. Методы селекции сосны обыкновенной
- •11.1.4. Некоторые результаты селекции сосны обыкновенной
- •11.1.5, Репродукция селекционного материала сосны обыкновенной
- •11.2. Селекция сосны кедровой сибирской
- •11.2.1. Направление селекции
- •11.2.2. Исходный материал для селекции
- •11.2.3. Методы и результаты селекции
- •11.2.4. Репродукция ценных форм
- •11.3. Селекция ели европейской и ели сибирской
- •11.3.1. Направление селекции и сортовой идеал ели
- •11.3.5. Репродукция селекционного материала ели
- •11.4. Селекция пихты сибирской
- •11.4.2. Исходный материал для селекции пихты сибирской
- •11.4.3. Методы, некоторые результаты селекции и репродукция пихты
- •11.5. Селекция лиственницы
- •11.5.1. Направление селекции
- •11.5.2. Исходный материал для селекции
- •11.5.3. Методы и результаты селекции лиственницы
- •Показатели роста искусственных гибридов лиственницы на подзолах; возраст 21 год (по данным а. В. Альбенского, 1959)
- •11.5.4. Размножение хозяйственно-ценных форм лиственницы
- •Глава 12
- •12.1. Селекция дуба черешчатого
- •12.1.1. Направление селекции и сортовой идеал дуба черешчатого
- •12.1.2..Исходный материал для селекции дуба черешчатого
- •Методы селекции дуба черешчатого
- •12.1.4. Некоторые результаты селекции дуба черешчатого
- •12.1.5. Репродукция селекционного материала дуба черешчатого
- •12.2. Селекция бука
- •12.2.1. Генофонд и исходный материал для селекции бука
- •12.2.2. Методы и результаты селекции бука
- •12.2.3. Размножение лучших форм бука
- •12.3. Селекция ильмовых
- •12.3.1. Направление селекции и сортовой идеал ильмовых
- •12.3.2. Исходный материал для селекции ильмовых
- •12.3.3. Методы и результаты селекции
- •12.4. Селекция ясеня
- •12.4.1. Направления селекции и исходный материал
- •12.4.2. Методы и результаты селекции
- •12.4.3. Воспроизводство лучших форм ясеня
- •Глава 13
- •13.1. Селекция тополя
- •13.1.1. Направление селекции и сортовой идеал тополя
- •13.1.2. Исходный материал для селекции тополя Видовой потенциал рода Populus l.
- •13.1.4. Основные результаты селекции тополя
- •13.1.5. Размножение сортовых тополей
- •13.2. Селекция осины
- •13.2.1. Направление селекции и сортовой идеал осины
- •13.22. Исходный материал для селекции осины.
- •25 М; средний диаметр 26,5 см; запас
- •350 М3/га. Пораженность осиновым
- •13.2.2. Методы селекции осины
- •13.2.4. Результаты селекции осины
- •13.2.5. Размножение отселектированных форм осины
- •13.3. Селекция ивы
- •13.3.1. Направление селекции и исходный материал ивы
- •13.3.2. Методы и результаты селекции ивы
- •13.3.3. Воспроизводство сортового посадочного материала
- •13.4. Селекция березы
- •13.4.1. Направление селекции и сортовой идеал березы
- •13.4.2. Исходный видовой материал для селекции берез
- •13.4.3. Березы секции Costatae Regel
- •13.4.4. Березы секции Albae Regel
- •13.5. Селекция карельской березы
- •13.5.1. Направление селекции и сортовой идеал карельской березы
- •13.5.2. Исходный материал карельской березы
- •13.5.4. Репродукция селекционного материала, создание культур и плантаций
- •13.6. Селекция ольхи
- •13.6.1. Направление селекции и исходный материал
- •1. Секция Alnobetula w.D. Koch.
- •2. Секция Gymnothyrsus Spach.
- •13.6.2. Результаты селекционных исследований
- •13.6.3. Семеноводство ольхи
- •Глава 14.
- •14.1. Селекция ореха
- •14.1.1. Направление селекции и сортовой идеал
- •14.1.2. Исходный материал
- •14.1.3. Методы селекции
- •14.1.4. Результаты селекции
- •14.1.5. Воспроизводство сортового материала
- •14.2. Селекция лещины
- •14.2.1. Направление селекции и сортовой идеал
- •14.2.2. Исходный материал для селекции
- •14.2.3. Методы селекции
- •14.2.4. Результаты селекции
- •14.2.5. Воспроизводство сортового материала
- •14.3. Селекция облепихи
- •14.3.1. Направление селекции и сортовой идеал
- •14.3.2. Исходный материал
- •14.3.3. Методы селекции
- •14.3.4. Результаты селекции
- •14.3.5. Воспроизводство сортового материала
- •14.4. Селекция жимолости
- •14.4.1. Исходный материал жимолости со съедобными плодами, сортовой идеал и некоторые результаты селекции
- •14.4.2. Размножение и агротехника выращивания жимолости
- •14.4.3. Создание промышленных плантаций жимолости
- •Глава 15.
- •15.1. Лжетсуга Мензиса
- •15.2. Сосна скрученная
- •15.3. Сосна веймутова
- •15.4. Ель ситхинская
- •15.5. Селекция дуба красного (северного)
- •15.6. Селекция акации белой
- •Глава 1. Селекция как наука. Общие принципы
- •Глава 6. Генетическая оценка селекционного материала
- •Глава 7. Лесное семеноведение как наука.
- •Глава 8. Семенное размножение селекционно
- •Глава 9. Вегетативное размножение лесных древесных пород 198
- •Глава 10. Клональное микроразмножение древесных растений 209
- •Глава 11. Селекция хвойных древесных пород 219
- •Глава 12. Селекция твердолиственных древесных пород 261
- •Глава 13. Селекция мягколиственных древесных пород 310
- •Глава 14. Селекция орехоплодных и дикорастущих
- •Глава 15. Селекция интродуцентов 447
Условия культивирования и этапы микроразмножения
После тщательного перемешивания компонентов питательной среды регулируется рН всей смеси путем добавления 0,1 N NaOH и 0,1 N НС1. Для среды Мурасиге — Скуга рН устанавливается на уровне 5,7-5,8, у среды для культивирования древесных растений (WPM) оптимальная рН=5,2.
Факторы окружающей среды, такие как свет, температура и состав воздуха, могут влиять на рост и развитие клеток в культуре органов и тканей. Действие этих факторов взаимосвязано. Обычно микроклональное размножение древесных растений проводят при нормальной комнатной температуре и при сохранении того фотопериода, который наблюдается в это время в природе. Чтобы установить оптимальные параметры внешней среды, для многих видов древесных растений необходимо провести дополнительные исследования.
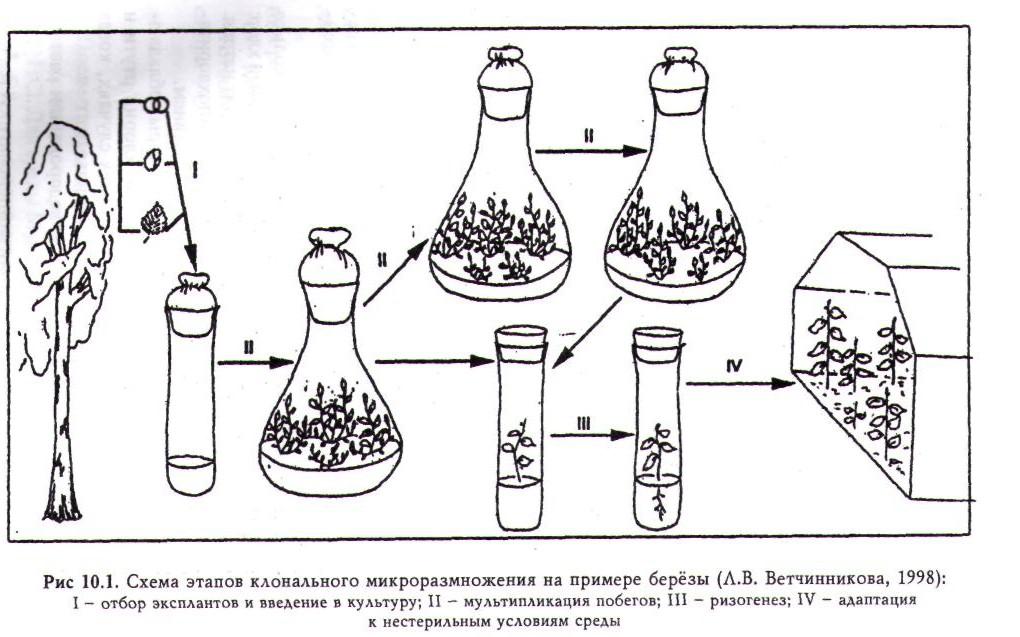
Процесс микроразмножения растений состоит из нескольких этапов. Большинство исследователей выделяют три этапа: эксплантирование исходного материала, собственно микроразмножение, укоренение размноженных побегов. При получении посадочного материала древесных растений методом микроклонирования целесообразно выделить и четвертый этап — адаптации регенерантов к нестерильным условиям среды (рис. 10.1). ,
Отбор эксплантов и введение их в культуру. Для микроразмножения древесных растений используют два основных типа исходного материала: 1) ювенильный (семена и их отдельные части, а также части проростков); 2) молодые ткани взрослых растений (почки, хвоя, ткани листа, побеги). Чаще в качестве экспланта служит ювенильный материал.
Перед введением в культуру материал стерилизуют. Установлено, что из всех видов растений древесные породы — самый трудный и сложный объект для получения культуры тканей, так как все типы исходного материала у них сильно заражены (Г.П. Бутова, 1989). Стерилизацию проводят очень осторожно, чтобы не повредить нежные ткани экспланта; концентрация стерилизующих агентов подбирается на возможно более низком уровне.
Стерилизующие растворы могут быть разделены на несколько групп. Первая из них включает растворы, содержащие активный хлор: хлорамин, хлорная известь, гипохлорит кальция и гипохлорит натрия. Хлорамин используется чаще. Этот препарат наряду с гипохлоритами обладает наименее выраженным токсическим действием.
Вторая группа включает ртутьсодержащие растворы, обладающие наибольшим дезинфицирующим эффектом: хлорид ртути и диацид. Растворы второй группы используют в тех случаях, когда препараты первой группы оказались неэффективными.
Иногда материал стерилизуют перекисью водорода или раствором иода.
Для повышения эффективности стерилизации практикуется последовательное применение стерилизующего агента с 70%-ным эти ловым спиртом. Эксплант опускают на 1-3 % в спирт, а затем переносят в стерилизующий раствор. Перед высадкой на питательную среду материал ополаскивают в стерильной воде.
Мультипликация побегов. При правильно подобранной питательной среде, надежной стерилизации и подходящих условиях культивирования в пробирке или колбе образуется несколько побегов. Часть из них пересаживают на новую среду для образования корней, а другую повторно культивируют для увеличения количества побегов. Этот процесс повторяют многократно до получения требуемого количества посадочного материала.
Ризогенез. Питательная среда для культивирования побегов с целью образования на них корней обычно несколько отличается от среды, которая использовалась на первом этапе. Установлено, что для многих растений необходимо использовать среду с низким содержанием солей. Так, в среде Мурасиге — Скуга концентрация солей уменьшается в два или даже в четыре раза. Некоторые травянистые растения не нуждаются в добавлении в среду регуляторов роста, но чаще требуются ауксины. Время, необходимое для формирование корней, варьирует от 10 до 15 дней. Растения из пробирки пересаживают, когда корни достигнут 5 мм длины. Более длинные корни могут при пересадке поломаться.
Адаптация к нестерильным условиям среды. Для переноса растений из культуральных сосудов в почву требуется особая осторожность. Корни промываются для удаления налипшей на них питательной среды. Первые 10-15 дней в теплице поддерживается высокая влажность (90-100%). Для древесных растений в этих целях используют установки искусственного тумана. Также необходимо защищать растения от прямого солнечного света.
***
Клональное микроразмножение — принципиально новый способ получения клонов у древесных растений. Одним из важных преимуществ этого способа является то, что удается тиражировать растения, которые с трудом или совсем не размножаются вегетативно, черенками или прививкой. Массовое использование клонального микроразмножения позволяет перевести искусственное лесовосста-новление на более высокий уровень, улучшить культуру лесохозяйственного производства. Так же как совершенствование приемов и методов лесного семеноведения определяет прогресс в других областях лесной науки, клональное микроразмножение способствует внедрению в лесное хозяйство достижений лесной селекции, семеноводства и сортовыведения.
Универсальной технологии клонального микроразмножения нет; питательные среды и условия культивирования подбираются для каждого вида, а часто и для индивидуального древесного растения опытным путем, защищены свидетельствами на изобретение и патентами. Вопрос о приобретении патента в каждом конкретном случае должен решаться специалистами с учетом технологических возможностей предприятия, ценности вида или сорта, экономической целесообразности.

Вопросы для самопроверки
Что такое клональное микроразмножение?
Что необходимо для правильной организации работ по микроразмножению?
Какие основные вещества входят в состав питательных сред и их действие?
Опишите условия культивирования эксплантов.
Назовите основные этапы микроразмножения.
