
Клин рук-во по ЧМТ том 2 / ГЛАВА 8
.docИзвестно, что восстановленный и окисленный гемоглобин имеют различные спектры поглощения в инфракрасной области спектра, что позволяет оценивать их содержание количественно. Это позволяет измерить в мониторном режиме насыщение гемоглобина кислородом в отдельных регионах головного мозга (rSO2). Результаты исследования на здоровых испытуемых показали, что нормальные величины rSO2 лежат в пределах 60—80 % [48, 49, 50].
При снижении регионарного мозгового кровотока на протяжении даже короткого периода времени ниже 10 мл/100 г.мин, происходит неизбежная гибель нейронов. При снижении регионарного МК ниже 40 мл/100г/мин компенсаторно повышается экстракция кислорода мозгом, что в конечном итоге приводит к снижению rSO2.
Известно, что одним из первых компенсаторных механизмов, направленных на ликвидацию тканевого дефицита О2, является увеличение его экстракции из протекающей крови. Результатом повышенной тканевой экстракции кислорода является неизбежное снижение содержания кислорода в оттекающей венозной крови, и, прежде всего той его фракции, которая связана с гемоглобином. Метод ЦО позволяет уловить именно этот процесс и оценить его количественно (рис. 8—14) в условиях непрерывного и продолженного измерения.
Исследования проведенные с использованием метода NIRS в остром периоде тяжелой ЧМТ дали неоднозначные результаты у различных авторов. В ряде исследований [49] этот метод показал высокую чувствительность в выявлении нарастающей церебральной гипоксии наряду с традиционно используемым методом электроэнцефалографии. В других исследованиях [28] показана возможность его применения для предположения о наличии внутричерепных кровоизлияний. В то же время существуют существенные ограничения использования метода, связанные с возможными значительными погрешностями из-за подкожно расположенных гематом, увеличенной толщины костей черепа, анемии и т.д. [41].
В целом применение метода оправдано в сочетании с другими методами мониторинга, поскольку дает дополнительную информацию о состоянии кровообращения и метаболизма мозга, получаемую непрерывно в динамике и неинвазивно (см. рис. 8—2).
221
Клиническое руководство по черепно-мозговой травме
8.1.5. Югулярная венозная оксиметрия
Югулярная венозная оксиметрия метод традиционно используемый в комплексе мониторинга у нейрохирургических больных [3, 4, 12, 18]. Методом непрерывной регистрации насыщения кислородом оттекающей от мозга венозной крови (SjvO2) югулярная венозная оксиметрия стала после внедрения фиброоптических оксиметрических датчиков, вводимых в луковицу внутренней яремной вены и соединенных интерфейсом с прикроватным монитором (8, 25, 62]. Помимо данных прямой оксиметрии югулярная венозная оксиметрия позволяет оценивать баланс между потреблением кислорода и его доставкой, который может быть вычислен путем уравнения:
АВРО2= (СаО2) - (CjvO2) = (Hgbx l,39xSaO2 +0,003хРаО2) - (Hgbxl,39xSjvO2+ 0,003xPjvO2) = Hgbxl,39x(SaO2- SjvO2) + 0,003 (PaO2- PjvO2) = Hgbxl,39 <SaO2 - SjvO2) (пренебрегая количеством растворенного О2, так как в условиях нор-мотермии оно незначительно)
Так как при большинстве условиях SaO2 = 100%, и если содержание гемоглобина остается постоянным, тогда:
АВРО2с* 100 - SjvO2,
где СаО2 — содержание О2 в артериальной крови;
CjvO2 — содержание О2 в югулярной венозной крови;
Hgb = концентрация гемоглобина (г/дл);
SaO2 = насыщение гемоглобина кислородом в артериальной крови; SjvO2 = насыщение гемоглобина кислородом в луковице внутренней яремной вены;
РаО2 = парциальное напряжение кислорода в артериальной крови; PjvO2 = парциальное напряжение кислорода в луковице внутренней яремной вены).
В настоящее время югулярная венозная оксиметрия является одним из наиболее точных методов on-line диагностики церебральной ишемии и ее последствий. В связи с этим этот метод входит в стандарт диагностического комплекса у больных с ЧМТ в ходе проведения вентиляционной, особенно гипервентиляционной терапии. Поскольку МК изменяется примерно на 3% на каждый мм рт. ст. РаСО2 (в диапазоне 25—65 мм рт. ст.), то гипервентиляция, сопровождаемая снижением РаСО2 уменьшит МК, повысит АВРО2 за счет снижения SjvO2
В норме гипервентиляция не приводит к необратимому повреждению мозга. У пострадавших с тяжелой ЧМТ, особенно при сниженном МК, как результат первичного травматического воздействия [10], г и пер вентиляция может приводить к тяжелой ишемии мозга [19]. Снижением МК и развитием ишемии мозга объясняют результаты исследования Muizelaar и соавт., сообщившие, что гипервентиляция при тяжелой ЧМТ ухудшает исход [53].
У больных с субарахноидальными кровоизлияниями (САК), внутричерепными гематомами и тяжелой ЧМТ даже при поддержании РаСО2 в пределах 28—35 мм рт. ст. отмечали развитие эпизодов
222
Мультимодальиый физиологический мониторинг при тяжелой черепно-мозговой травме
выраженной десатурации крови взятой из луковицы внутренней яремной вены [70, 71, 75].
При дыхательном алкалозе, сопутствующем гипервентиляции происходит сдвиг кривой диссоциации оксигемоглобина влево (эффект Бора), что проявляется парадоксальным повышением SjvO2 несмотря на одновременное снижении МК. Клинически значимым этот эффект становится при рН >7,6. Кислород также не может экстрагироваться тканями из оксигемоглобина в случаях отравления цианидами или моноксидом углерода. В этих условиях несмотря на тканевую гипоксию величина SjvO2 будет несоответственно повышенной [21].
В норме МК тесно сопряжен и взаиморегулируется скоростью церебрального метаболизма кислорода (СЦМО2) так, что локальный (регионарный) МК повышается или снижается в зависимости от метаболической потребности мозговой ткани [64]. Эта сопряженность сохраняется и при ряде состояний, изменяющих церебральный метаболизм кислорода (судороги, изменения температуры мозга) приЧМТ [46, 61, 70].
Известно, что при судорожной активности потребление мозгом кислорода (ПМО2) заметно повышается, так же как и при лихорадке возрастает скорость церебрального метаболизма, соответственно потребности возрастает и МК.
Гипнотики и обычно используемые ингаляционные анестетики подавляют и электрическую активность мозга и потребление мозгом кислорода, исключая закись азота, которая повышает ЭЭГ активность, ПМО2 и скорость МК [45]. В последнее время появились новые анестетики типа пропофол, которые выступают в роли модуляторов метаболизма улучшая баланс между доставкой и потреблением мозгом кислорода [12].
Целенаправленное снижение скорости церебрального метаболизма, например при проведении барбитуровой комы преследует собой, в том числе, снижение МК и соответственно сосудистого компонента ВЧГ [61]. Суть заключается в том, что при нормальном сопряжении СЦМО2 и МК величина SjvO2 остается относительно постоянной.
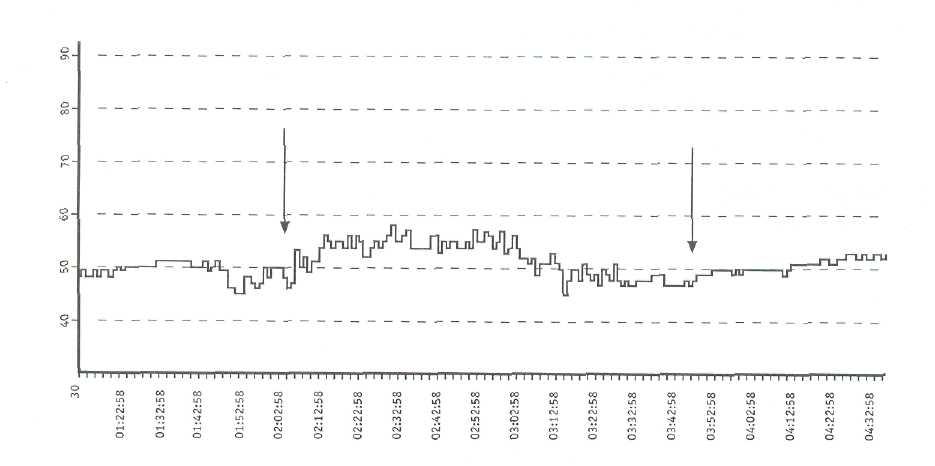
Принципиально важным в ходе проведения мониторинга ЮВО является контроль повышения или снижения SjvO2. В целом, наиболее частыми причинами снижения SjvO2 являются ВЧГ, гипокап-ния и системная гипотензия [21, 45, 46]. В недавнем исследовании Robertson и соавт. [66] выявили 112 эпизодов снижения SjvO2<50% у 39% из 177 обследованных больных. Если один эпизод десатурации удваивал риск неблагоприятного исхода (по
ШИГ), то множественные эпизоды — повышали этот риск в 14 раз. При ВЧГ частота снижения SjvO2 <50% возрастала с 26% до 55%.
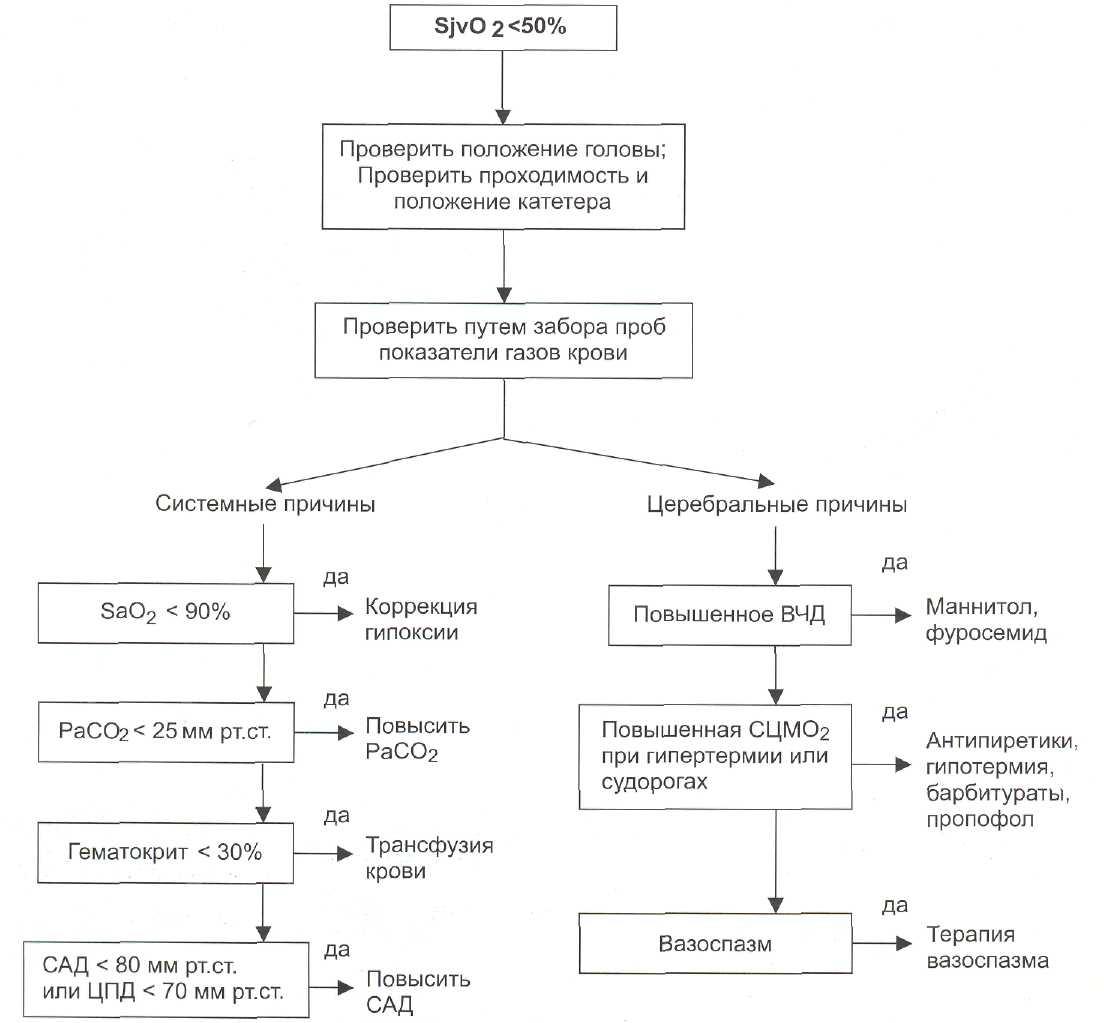
Последовательность действий при критическом снижении SjvO2<50% стандартна вне зависимости от основной патологии и включает в себя проверку положения головы больного (исключение компрессии вен), положение (проходимость) катетера, при необходимости его калибровку и дифференциальный диагноз значения каждого из двух основных факторов ишемии — системного и церебрального (рис. 8-15).
Повышение SjvO2>75%, как правило, указывает на возможную гиперемию мозга. Gopinath и соавторы [29] выявили значительное повышение SjvO2 у больных с внутричерепными гематомами сразу после их удаления. В то же время, более тяжело послеоперационный период протекал, если SjvO2 оставался высоким. Они объяснили это венозной гиперемией сопровождаемой ВЧГ.
Данные SjvO2 мониторинга позволяют обосновывать эффективность проводимой интенсивной терапии. В серии клинических наблюдений, в которых высокие цифры SjvO2 при тяжелой ЧМТ сопровождались ВЧГ [14], дифференцированное использование вентиляционных режимов и барбитуровой комы позволило улучшить результаты лечения.
Miller и соавторы [51] предложили исходить из двух основных факторов при интенсивной терапии ВЧГ — гиперемии мозга и отека головного мозга. При обследовании 17 пациентов для дифференциального диагноза гиперперфузии и отека мозга при ВЧГ служили данные SjvO2 мониторинга мозга. Повышение SjvO2 указывало на механизм повышения ВЧД в виде гиперемии мозга — наиболее эффективны в этих случаях для борьбы с ВЧГ были барбитураты. Нормальные или сниженные значения SjvO2 предполагали как ведущий фактор ВЧГ — отек мозга и наиболее эффективным стало применение осмодиуретиков.
Schneider и соавторы используя SjvO2 мониторинг определяли оптимальный угол подъема головы у больных с ЧМТ и ВЧГ (обычно 15—30 градусов) [71].
Cruz J. [20] для снижения риска гипервентиляции предложил допускать уменьшение РаСО2 до тех пор, пока коэффициент экстракции кислорода мозгом (O2ER) оставался в нормальных пределах. При помощи мониторинга SjvO2 стало возможно выявить больных, у которых МК достигая критического уровня делает опасным использование гипервентиляции для снижения ВЧГ.
223
Клиническое руководство по черепно-мозговой травме

8.1.6. Нейрофизиологические методы
У больных с травматическим поражением мозга в коматозном состоянии в течение длительного времени затруднена оценка многих церебральных функций. Нейрофизиологические методы позволяют проводить продолженную регистрацию с последующей интерпретацией биоэлектрической функциональной активности мозга у коматозных больных в остром периоде тяжелой ЧМТ. И, с определенной достоверностью, судить о степени травматического повреждения мозга и наличии очаговых дефектов различной локализации, хотя информативность и значимость полу-
чаемой информации значительно уменьшилась с появлением современного рентгено-радиологического комплекса обследования (КТ, МРТ и т.д.).
Применение нейрофизиологических методов в остром периоде тяжелой ЧМТ существенно ограничено наличием ряда технологических проблем: артефактов регистрации, связанных с обилием прикроватного оборудования и вызываемыми им «наводками», с двигательной активностью больных, применением седативных и релаксирующих препаратов, с подкожными и подоболочечными скоплениями крови и ликвора и т.д. В связи с этим до настоящего времени дискутируются вопросы
224
Мулътимодальный физиологический мониторинг при тяжелой черепно-мозговой травме
значимости отдельных нейрофизиологических методов для целей нейромониторинга в остром периоде тяжелой ЧМТ [34, 56], подробно представленных в в первом томе настоящего руководства.
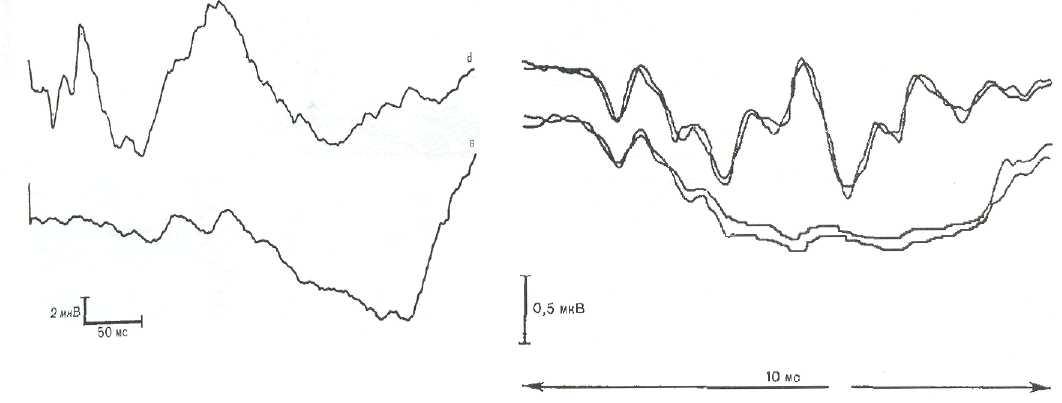
Метод коратколатентных вызванных потенциалов позволяет объективно оценить сохранность стволовых таламических и неокортикальных структур мозга [7]. В этих целях наиболее часто используют запись акустических стволовых (АСВП) и соматосен-сорных (ССВП) вызванных потенциалов (рис. 8—16).
Относительная простота проведения и неинвазив-ность исследований АСВП и ССВП позволяет изучить состояние сенсорного пути в динамике посттравматического периода и широко использовать данные методы в общем комплексе прикроватного мониторинга.
Появившаяся в последнее десятилетие методика регистрации магнитных вызванных потенциалов дает возможность изучить состояние моторной коры и пирамидных путей [33, 78].
МУЛЬТИМОДАЛЬНОГО ФИЗИОЛОГИЧЕСКОГО МОНИТОРИНГА
В последнее десятилетие наблюдается бурное развитие методов, позволяющих все более точно, оценивать состояние больного, в том числе в условиях отделения реанимации с использованием современных технологий мультимодального физиологического мониторинга.
В то же время, специфика исследуемого объекта при мультимодальном мониторинге больных с тяжелой ЧМТ обусловила формирование самостоятельного направления клинических исследований, определяемого как нейромониторинг.
Нейромониторинг в остром периоде тяжелой ЧМТ определяется как совокупность методов оценки состояния и функций поврежденного (вследствие травмы) мозга и имеет основной целью предупреждение вторичных его повреждений в условиях реанимационного обеспечения и проводимой интенсивной терапии.
При всем обилии имеющихся, в настоящее время, инструментальных методов исследования мозга можно проследить четыре основные тенденции в развитии нейромониторинга:
1. Приближение методов исследования к постели тяжелого больного (см. рис. 8—1).
Позволяет предупредить или своевременно исключить такие факторы вторичного поражения мозга, как его сдавление отсроченной внутричерепной гематомой, нарастание отека, дислокации мозга. С этой целью КТ и МРТ устанавливают в непосредственной близости от отделения реанимации. Более того разработан мобильный КТ, который может быть использован у постели больного в отделении реанимации.
Безусловно, следует учитывать то, что прикроватный мониторинг церебральных функций позволяет избежать опасностей, связанных с перемещением больного к месту исследования (необходимость отсоединения пациента от респиратора и монитора, ослабление режима наблюдения персоналом, снижение эффективности оказания возможной реанимационной поддержки в ходе транспортировки и т.д.).
2. Приоритетность развития неинвазивных методов оценки церебральных и системных функций (рис. 8—17).
225
15. Зак 851.
Клиническое руководство по черепно-мозговой травме
Необходимость
комплексной оценки, получаемых
различными методами нейромониторинга
данных обусловлена прежде всего
тем, что ни
один
из выше
перечисленных методов, сам по себе, не
является
исчерпывающим. Каждый из них дополняет
друг
друга и подтверждает данные клинического
3. Повседневное клиническое использование научных высоко технологичных методов изуче ния состояния мозга.
То, что раньше было уделом научных исследований, б настоящее время, обоснованно применяется для рутинной оценки церебральных функций в клинических условиях: измерение внутричерепного давления (ВЧД), мозгового кровообращения, метаболизма мозга, спонтанной и вызванной биоэлектрической активности мозга.
Рис. S—-17. Совокупность неинвазивных методов клинического исследования.
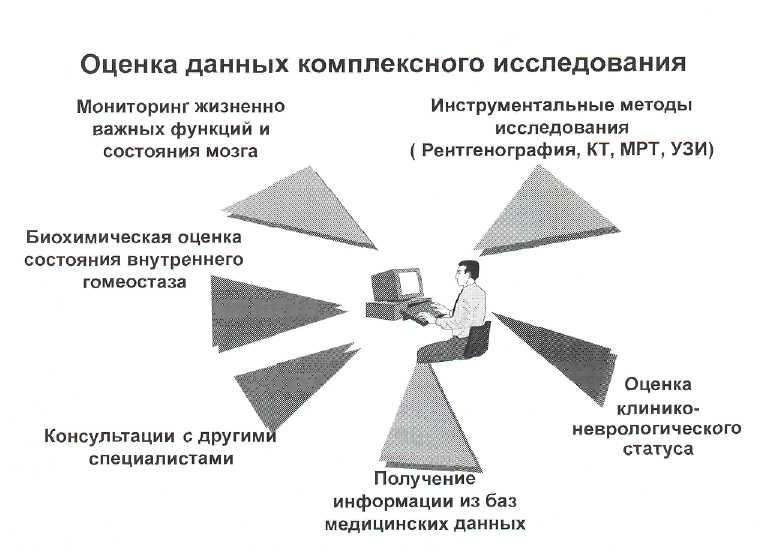
4. Проведение комплексной оценки большой совокупности данных, полученных с помощью различных методов исследова ния, (рис. 8—18) в режиме ре ального времени («on-line» мониторинг).
Рис. 8—18. Комплексная оценка данных различных методов исследования в режиме «реального времени» с помощью компьтерных технологий.
Применение методов ней-ромониторинга в режиме реального времени подразумевает непрерывное получение информации о всех монито-рируемых параметрах, с одновременным использованием расчетных методов (расчет церебрального перфузионного давления, транспорта газов, работы сердца и т.д.), выведение их на экран прикроватного монитора и (или) на монитор рабочей станции врача (медсестры). Для этого используют возможности монитор-но-компьютерной сети и соответствующего программного обеспечения в виде электронной истории болезни.
226
Мулътимодалънып физиологический мониторинг при тяжелой черепно-мозговой травме
обследования больного (неврологический и соматический статус). Только владение всей полнотой клинической информации, при условии ее экспертной оценки и в сопоставлении с результатами проводимой интенсивной терапии может служить основой последующего успеха в лечении больных с тяжелой ЧМТ.
Поиск оптимальных сочетаний методов нейро-мониторинга ведется, в настоящее время, в различных клиниках мира и определен их возможностями и имеющимся клиническим опытом. Тем не менее, основой этого поиска является соблюдение обших правил ведения больных в остром периоде тяжелой ЧМТ, изложенных в Рекомендациях по лечению при тяжелой черепно-мозговой травме [32].
Литература
-
Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. Видар, Москва, 1997, 712 с.
-
Abu-Judeh H.H., Parker R., Singh M.. el-Zeftawy H., Atay S,, Kumar M., Naddaf S., Alcksic- S., Abdel- Dayem H.M. SPET brain perfusion imaging in mild trau matic brain injury without loss of consciousness and normal computed tomography. Nucl Med Commun, 1999, Jun; 20 (6): p. 505-510.
-
Andrews P.J., Dearden N.M., Miller J.D. Jugular bulb cannulation: Description of acannulation technique and val idation of a new continuous monitor. Br J Anaesth 67, 1991: p. 553-558.
-
Andrews P.J., Colquhoun A.D. Detection of cerebral hypoperfusion during cardiopul-monary bypass: Continuous measurement of cerebral venous oxyhaemoglobin saturation during myocardial revascularisation. Anaesthesia, 1994. 49: p. 949-953.
-
Ausman J.I., McCormic P., Stewart M. el al. Cerebral oxygen metabolism during hypothermic circulatory arrest in humans. J Ncurosurg, 1993. 79: p. 810—815.
-
Baker A.J., Moulton R.J., MacMillan V.H., Shedden P.M. Excitatory amino acids in cerebrospinal fluid following traumatic brain injury in humans. J Neurosurg, 1993, Sep; 79 (3): p. 369-372.
-
Barelli A., Valentc M.R., Clemente A., Bozza P., Proict- ti R., Delia Corte F. Serial multimodality-evoked potentials in severely head-injured patients: diagnostic and prognostic im plications. Crit Care Med, 1991, Nov;19 (11): p. 1374-1381.
-
Bavetta S., Norris J.S., Wyatt M., Sutcliffe J.C., Ham- lyn P.J. Prospective study of zero drift in fiberoptic pressure monitors used in clinical practice. Journal of Neurosurgery, 1997, 86: p. 927-930.
-
Bolognese P., Miller J.I., Heger I.M. et al. Laser-Dop- pler flowmetry in neurosurgery. Journal of Neurosurgical Anesthesiology, 1993, 5, p. 151-158.
-
Bouma G.J., Muizelaar J.P., Choi S.C., et al.: Cere bral circulation and metabolism after severe traumatic brain injury: the elusive role of ischemia. J Neurosurg, 1991, 75: p. 685-693.
-
Bruce D.A., LangfittT.W., Miller J.D. et al. Regional cerebral blood flow, intracranial pressure, and brain metab-
olism in comatose patients. Journal of Neurosurgery, 1973, 38: p. 131-144.
-
Bullock R., Stewart L., Rafferty C. ct al. Continuous monitoring of jugular bulb oxygen saturation and the effect of drugs acting on cerebral metabolism. Acta Ncurochir Sup- pi., Wien, 1993, 59: p. 113-118.
-
Carter L.P., Weinand M.E., Oommen K.J. Cerebral blood flow (CBF) monitoring in intensive care by thermal diffusion. Acta Neurochirurgica (Suppl), 1993, 59, p. 43—46.
-
Chan K.H., Dearden KM., Miller J.D., Andrews P.J., MidgleyS. Multimodality monitoring as a guide to treat ment of intracranial hypertension after severe brain injury. Neurosurgery, 32 (4): 547—552; discussion p. 552—553, 1993.
-
Chan K.H., Dearden N.M., Miller J.D., Midgley S., Piper l.R.Transcranial Doppler waveform differences in hyperemic and nonhyperemic patients after severe head in jury. Surg Neural, 1992, 38 (6): p. 433-436.
-
Chan K.H., Dearden N.M., Miller J.D. The signifi cance of posttraumatic increase in cerebral blood flow veloc ity: a transcranial Doppler ultrasound study. Neurosurgery, 1992, 30: 5, p. 697-700.
-
Chan K.H., Miller J.D., Dearden N.M. Intracranial blood flow velocity after head injury: relationship to sever ity of injury, time, neurological status and outcome. J Neu- rol Neurosurg Psychiatry, 1992, 55: 9, p. 787—791.
-
Chieregato A., Targa L, Zatelli R: Limitations of jug ular bulb oxyhemoglobin saturation without intracranial pres sure monitoring in subarachnoid hemorrhage. J Neurosurg Anesthesiol, 1996, 8: p. 21-25.
-
Cold G.E. Does acute hypcrventilation provoke cere bral oligemia in comatose patients after acute head injury. Acta Neurochir Wien, 1989, 96: p. 100-106.
-
Cruz J., Gcnnarelli T.A., Hoffstad O.J. Lack of rele vance of the Bohr effect in optimally ventilated patients with acute brain trauma. J Trauma, 1992, 33: p. 304—310.
-
Cruz J, Miner ME, Allen SJ, et al: Continuous mon itoring of cerebral oxygenation in acute brain injury: injec tion of mannitol during hyperventilation. J Neurosurg, 1990, 73: p. 725-730.
-
Czosnyka M., Kirkpatrick P.J., Pickard J.D. Multimo- dal monitoring and assessment of cerebral haemodynamic reserve after severe head injury. Cerebrovasc Brain Mctab Rev, 1996, 8: 4, p. 273-295.
-
Czosnyka ML, Smielewski P., Kirkpatrick P., Menon D.K., Pickard J.D. Monitoring of cerebral autoregulation in head-injured patients. Stroke, 1997, 27: 10, p. 1829-1834.
-
Diringer M.N., Yundt K., Videen Т.О., Adams R.E., Zazulia A.R., Deibert E., Aiyagari V., Dacey R.G. Jr, Grubb R.L. Jr, Powers W.J. No reduction in cerebral metabolism as a result of early moderate hyperventilation following se vere traumatic brain injury. / Neurosurg, 2000, Jan; 92 (1): p. 7-13.
-
Feldman Z., Robertson C.S. Monitoring of cerebral hemodynamics with jugular bulb catheters. Critical Care Clinics, 1997, 13: p. 51-77.
-
Fontaine A., Azouvi P., Remy P., Bussel В., Samson Y. Functional anatomy of neuropsychological deficits after severe traumatic brain injury. Neurology, 1999, Dec 10; 53 (9): p. 1963-1968.
-
GancsT., LundarT. Ncurointensive monitoring. Ex periences with neurophysiological examinations. Tidsskr Nor Laegeforen, 1991, Nov 10; 111 (27): p. 3277-3278.
-
Gopinath S.P., Robertson C.S., Grossman R.G. et al. Near-infrared spectroscopic localization of intracranial he- matomas. Journal Neurosurgery, 1993, 79, p. 43—47.
227
Клиническое руководство по черепно-мозговой травме
-
 Gopinath
S.P., Cormio M., Ziegler J. et al. Intraop-
erative jugular
desaturation during surgery for intraopera-
tive
jugular desaturation during surgery for traumatic in-
tracranial
hematomas. Anesth Analg, 1996,
83: p.
1014—1021.
Gopinath
S.P., Cormio M., Ziegler J. et al. Intraop-
erative jugular
desaturation during surgery for intraopera-
tive
jugular desaturation during surgery for traumatic in-
tracranial
hematomas. Anesth Analg, 1996,
83: p.
1014—1021. -
Goraj B, Rifkinson-Mann S, Leslie DR, Lansen ТА, Kasoff SS, Tenner MS. Correlation of intracranial pressure and transcranial Doppler resistive index after head trauma. Am J NeuroradioL, 1994, 15: 7, p. 1333-1339.
-
Got D., Yonas H., Good W.F. Local cerebral blood flow by xenon-enhanced CT: current status, potential im provements and future directions. Cerebrovascular Brain Metabolism Review, 1989, 1: p. 68-86.
-
Guidelines for the management of severe head inju ry, Brain Trauma Foundation, 2000, Vol. 1.
-
Hallett M. Transcranial magnetic stimulation and the human brain. Nature, 2000, Jul 13; 406 (6792): p. 147-150.
-
Hutchinson D.O., Frith R.W., Shaw N.A., Judson J.A., Cant B.R. A comparison between electroenccphalogra- phy and somatosensory evoked potentials for outcome pre diction following severe head injury. Electroencephalogr Clin Neurophysiol, 1991, Mar; 78 [3): p. 228-233.
-
Kety S., Schmidt C. The nitrous oxide method for the quantitative determination of cerebral blood flow in man: Theory, procedure, and normal values. J Clin Invest, 1948. 27: p. 476-483.
-
Kiening K.L., Hartl R., Unterberg A.W., Schnider G-H., Bardt Т., Lanksch W.R. Brain tissue pO2-monitoring in comatose patients: Implications for therapy. Neurological research, 1997, V.19, June, p. 233—240.
-
Kordestani R.K., Counelis G.J., McBride D.Q., Martin N.A. Cerebral arterial spasm after penetrating cran- iocerebral gunshot wounds: transcranial Doppler and cere bral blood flow findings. Neurosurgery, 1997, 41: 2, p. 351 — 359; discussioino. p. 359—360.
-
Lam J.M., HsiangJ.N., Poon W.S. Monitoring of auto- regulation using laser Doppler flowmetry in patients with head injury. Journal of Neurosurgery, 1998, 86: 3, p. 438—445.
-
Langfitt T.W., Obrist W.D., Alavi A. et al. Computer ized tomography, magnetic resonance imaging and positron emission tomography in the study of brain trauma. Journal of Neurosurgery, 1986, 64: p. 760—767.
-
Lee E.J., Chio C.C., Chang C.H., Chen H.H. Prog- nostic significance of altered cerebral blood flow velocity in acute head trauma. J Formos Med Assoc, 1998, 96: p. 15—12.
-
Lewis SB, Myburgh JA, Thornton EL, Reilly PL. Cerebral oxygenation monitoring by near-infrared spectros- copy is not clinically useful in patients with severe closed- head injury: a comparison with jugular venous bulb oxime- try., Crit Care Med., 1996, Aug; 24 (8): p. 1334-1338.
-
Manno E.M. Transcranial Doppler ultrasonography in the neurocritical care unit. Crit Care Clin, 1998, Jan 13:1 p. 79-104.
-
Martin N.A., Patwardhan R.V., Alexander M.J., Africk C.2., Lee J.H., Shalmon E., Hovda D.A., Becker D.P. Characterization of cerebral hemodynamic phases fol lowing severe head trauma: hypoperfusion, hyperemia, and vasospasm. Journal of Neurosurgery, 1997, 87: 1, p. 9—19.
-
Matta B.F., Lam A.M. Nitrous oxide increases cere bral blood flow velocity during pharmacologically induced EEG silence in humans. J Neurosurg Anesthesiol, 1995, 7: p. 89-93.
-
Matta B.F., Lam A.M., MaybergT.S. et al. A critique of the intraoperative use of jugular venous bulb catheters during neurosurgical procedures. Anesth Analg, 1994, 79: p. 745-750.
46. Matta B.F., Lam A.M., Mayberg T.S. The influence of arterial oxygenation on cerebral venous oxygen saturation du ring hyperventilation. Can J Anaesth, 1994, 41: p. 1041 — 1046.
-
Matz P.G., Pitts L. Monitoring in traumatic brain injury. Clin Neurosurg, 1997, 44: p. 267—294.
-
McCormick P.W., Stewart M., Goetting M.G., et al. Regional cerebrovascular oxygen saturation measured by optical spectroscopy in humans.// Stroke., 1991, V. 22, № 5, p. 596-602.
-
McCormick P.W., Stewart M Goetting M.G., et al. Noninvasive cerebral optical spectroscopy for monitoring cerebral oxygen delivery and hemodynamics.// Crit.Care Med., 1991, V. 19, № 1, p. 89-97.
-
McCormic P.W., Stewart M Lewis G., et al. Intrace- rebral penetration of infrared light. Technical note.// J.Neurosurg., 1992, V. 76, № 2, p. 315-318.
-
Meixensberger J., Jager A., Dings J., Baunach S., Roosen K. Quality and Therapeutic Advances in Multimo- daiity Neuromonitoring Following Head Injury. In: B.L. Bauer and T.J. Kuhn (eds): Severe Head Injuries. Pathology, Diag nosis and Treatment. Springer., 1997, p. 99—108.
51.Miller J.D., Piper I.R., Dearden N.M.Management of intracranial hypertension in head injury: matching treatment with cause. Acta Neurochir (Suppl), 1993, 57: p. 152—159.
-
Muir J.K., Boerschel M., Ellis E.F. Continuous mon itoring of posttraumatic cerebral blood flow using laser-Dop- pler flowmetry. J Neurotrauma Winter, 1998, 9: p. 355—362.
-
Muizelaar J.P., Marmarou A., Ward J.D. et al. Ad verse effects of prolonged hyperventilation in patient with severe head injury: A randomized clinical trial. Journal of Neurosurgery, 1991, 75: p. 731-739.
-
Muttaqin Z., Uozumi Т., Kuwabara S., Arita K., Kurisu K., Ohba S., Kohno H., Ogasawara H., Ohtani M., Mikami T. Hyperacmia prior to acute cerebral swelling in severe head injuries: the role of transcranial Doppler monitoring. Acta Neurochir (Wien), 123: 1-2, p. 76-81, 1993.
-
Myburgh J.A. Respiratory and cardiovascular support. In: Reilly P., Bullock R. Head Injury. Chapman & Hall Med ical, 1997, p. 333-358.
-
Narayan R.K., Greenberg R.P., Miller J.D. et al.: Improved confidence of outcome prediction in severe head injury: a comparative analysis of the clinical examination, multimodality evoked potential, CT scanning and intracrani al pressure. Journal of Neurosurgery, 1981, 54: p. 751—762.
-
Nawashiro H., Shima K., Chigasaki H. Immediate cerebrovascular responses to closed head injury in the rat. J Neurotrauma, 1995, 12: 2, p. 189-197.
-
Newell D.W., Aaslid R., Stooss R., Reulen H.J. The relationship of blood flow velocity fluctuations to intracra nial pressure В waves. Journal of Neurosurgery, 1992, 76:3. p. 415-421.
-
Newell D.W., Weber J.P., Watson R. et al. Effect of transient moderate hyperventilation on dynamic cerebral autoregulation after severe head injuty. Neurosurgery, 1996, 39: p. 35-44.
-
Nilsson P., Gazelius В., Carlson H., Hillered L. Con tinuous measurement of changes in regional cerebral blood flow following cortical compression contusion trauma in the rat. J Neurotrauma, 1996, 13: 4, p. 201—207.
-
Nordstrom G.H., Messeter K., Sundbcrg B. et al. Cerebral blood flow, vasoreactivity and oxygen consump tion during barbiturate therapy in severe traumatic brain le sions. Journal of Neurosurgery, 1988, 68: p. 424—431.
-
Olesen K.S., Madsen P.L., Borme T. et al. Evaluation of a 7.5 French pulmonary catheter for continuous
228
Мультимодальный физиологический мониторинг при тяжелой черепно-мозговой травме
\щ of cerebral venous oxygen saturation. J Ncurosurg Anes-thesiol, 1994, 6: p. 233-238.
