
- •Введение
- •Используемые обозначения
- •I. Классы неорганических соединений
- •II. Эквивалент. Закон эквивалентов.
- •Задания к разделам I, II
- •Варианты заданий к разделу I, II
- •III. Растворы. Способы выражения концентрации
- •Молярная и нормальная концентрации
- •Задание к разделу III
- •Варианты заданий к разделу III
- •IV.Строение атома. Химическая связь
- •Варианты заданий к разделу IV
- •V.Энергетика химических реакций Химическая термодинамика. Движущая сила и определение направления химических реакций
- •Задание к разделу V
- •VI. Кинетика химических реакций.
- •Задание к разделу VI
- •Варианты заданий к разделам V, VI
- •VII. Ионные реакции в растворах электролитов Растворы сильных электролитов
- •Растворы слабых электролитов
- •Произведение растворимости
- •Обменные реакции в растворах электролитов. Гидролиз солей
- •Задание к разделу VII
- •46-Сульфида кадмия (II);
- •Номера вариантов к заданию VII
- •VIII. Окислительно - восстановительные реакции
- •Задания к разделу VIII
- •Варианты заданий к разделу VIII
- •IX. Электрохимия Гальванический элемент, электродный потенциал.
- •Электролиз расплавов и водных растворов солей
- •Задание к разделу IX
- •Варианты заданий для раздела IX
- •Библиографий список
- •Типы растворов
Растворы слабых электролитов
В растворах слабых электролитов существует равновесие между ионами и реально существующими недиссоциированными молекулами. В таких растворах концентрация ионов сравнительно мала, что дает основание пренебречь силами их электростатического взаимодействия и принять, что свойства растворов слабых электролитов определяются только равновесием диссоциации, которое полностью подчиняется закону действующих масс.
Константа, протекающего при этом равновесного процесса, называется константой диссоциации электролита и представляет собой отношение произведения концентраций ионов в растворе слабого электролита к концентрации его недиссоциированной части.
Это отношение остается постоянным для раствора любой концентрации слабого электролита при одной и той же температуре.
Рассмотрим равновесие в растворе слабого электролита НАН++ А-.
Обозначим общую концентрацию слабого электролита НА через С моль/л, тогда концентрация ионов [Н+]=[А-]=Сα моль/л, а концентрация недиссоциированной части электролита будет равна (С- Сα) моль/л, тогда константа диссоциации:
![]() ,
где α – степень диссоциации.
,
где α – степень диссоциации.
Данное выражение является законом разбавления Оствальда.
В тех случаях, когда степень диссоциации α << 0,1, при вычислениях, не требующих большой точности, можно принять, что С-Сα ≈ С или, то же самое, 1- α ≈ 1. Тогда
![]() или
или
![]() ,
откуда
,
откуда![]() .
.
Пример
1. Константа
диссоциации муравьиной кислоты составляет
![]() =2,1·10-4.
Вычислить степень диссоциации α и
концентрацию ионов водорода [Н+]
в 0,3М растворе кислоты.
=2,1·10-4.
Вычислить степень диссоциации α и
концентрацию ионов водорода [Н+]
в 0,3М растворе кислоты.
Решение. Уравнение диссоциации кислоты имеет вид НСООН Н+ + НСОО-
![]() ,
что соответствует 2,64 %.
,
что соответствует 2,64 %.
[Н+]=Сα=0,3·2,64·10-2=7,9·10-3 моль/л.
Пример 2. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора =1.
Решение:
![]() .
Определим молярную концентрацию
раствора.
.
Определим молярную концентрацию
раствора.
Масса одного литра раствора равна 1000 г, т.к. ρ=1г/мл. В 100 г раствора содержится 1 г вещества, следовательно в 1000 г раствора – 10 г.
![]() моль.
Таким образом СМ=0,22
моль/л.
моль.
Таким образом СМ=0,22
моль/л.
[Н+]=Сα=С![]() =
=![]() моль/л
моль/л
![]() .
.
Произведение растворимости
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе:
BaSO4 Ba2+ + SO42-
в осадке в растворе
Поскольку
в растворах сильных электролитов
состояние ионов определяется активностями,
то выражение константы равновесия для
данной системы имеет вид:
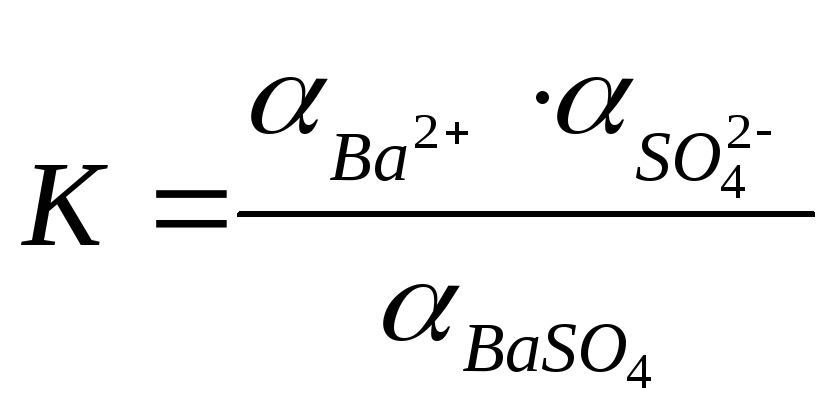 .
.
Активная
концентрация сульфата бария в растворе
есть величина постоянная, следовательно,
произведение
![]() является
величиной постоянной при данной
температуре и обозначается ПР.
является
величиной постоянной при данной
температуре и обозначается ПР.
Таким
образом, произведение активных
концентраций
![]() также
представляет собой постоянную величину,
называемую произведением растворимости
и обозначаемую ПР:
также
представляет собой постоянную величину,
называемую произведением растворимости
и обозначаемую ПР:
![]() .
.
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости) – есть величина постоянная при данной температуре.
Если электролит малорастворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициент активности ионов мало отличается от единицы. В подобных случаях произведение активностей ионов в выражениях для ПР может быть заменено на их молярные концентрации:
![]() .
.
Пример 4. Произведение растворимости иодида свинца (II) при 200С равно 8∙10-9.
Вычислить растворимость соли в моль/л и г/л.
Решение. Равновесие в системе малорастворимой соли иодида свинца (II) может быть представлено в виде уравнения РbI2 Pb2+ + 2I-.
Обозначим
искомую растворимость в моль/л через
S.
Тогда в насыщенном растворе РbI2
содержится S
моль/л ионов Pb2+
и 2S
моль/л ионов I-,
отсюда
![]()
![]() моль/л.
моль/л.
Поскольку мольная масса РbI2 равна 461 г/моль, то растворимость, выраженная в г/л, равна 1,3∙10-3∙461=0,6 г/л.
