
МОЛБИОЛ 2014-лекции / ОГК / Л4-Модификация-2-Сборка-1
.pdfПосттрансляционная модификация белков II
Лекция 4
2014г.
Липопротеины
•Липопротеинами называют белки, содержащие ковалентно связанные липиды (не путать с
липопротеиновыми комплексами);
•В составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры,
фосфолипиды, холестериды;
•Липопротеины в основном являются мембранными белками.
•Функционируют как структурные мембранные
белки, мембранно-связанные ферменты, участвующие в передаче сигнала, модификации белков и т. д.
2
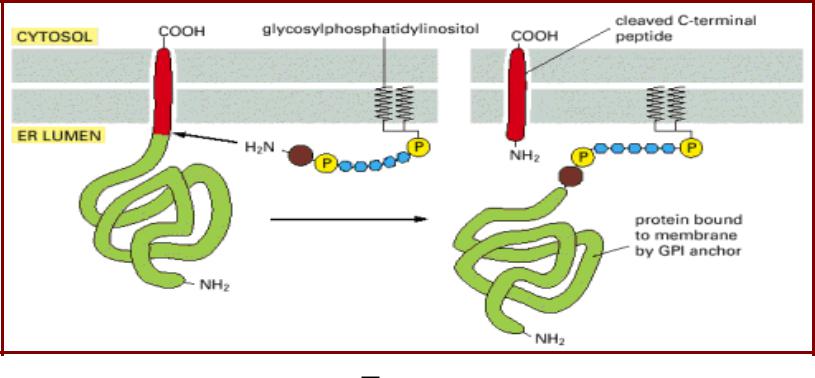
Липопротеины с С-концевой липидной
группировкой. Белки с GPI-якорем
•Гликозилфосфатидилинозитол (Glycosylphosphatidylinositol - GPI) –
присоединяется к С-концу белка после протеолитического отщепления С-концевого пропептида;
•Характерно для некоторых экстрцеллюлярных мембранных белков
(щелочная фосфатаза; neural cell adhesion molecule, N-CAM; decayaccelerating factor, DAF (CD55); протектин (CD59)).
•CD55 и CD59 участвуют в защите эритроцитов от лизиса системой комплемента. Клональное нарушение синтеза GPI в кроветворных стволовых клетках приводит к развитию повышенного гемолиза 3
эритроцитов (пароксизмальная ночная гемоглобинурия).
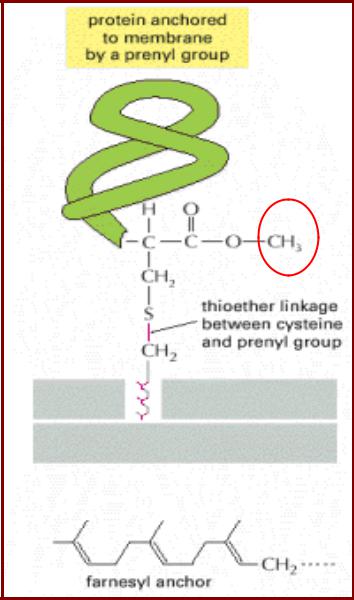
Липопротеины с С-концевой липидной группировкой. Пренилирование белков
•S-пренилирование белков – присоединение изопреноидов к атому серы Cys, локализованному на С-конце белка;
•Мотив – СaaХ, где С-Cys,
a-алифатическая ак (кроме Ala);
•X- Ser, Met, Gln – присоединение фарнезильной группировки (С15);
•X-Leu – присоединение геранилгеранильной группировки (С20);
•ААХ – отщепляется;
•Карбоксильная группа метилируется.
•Все модификации необходимы для функционирования белков;
•- присоединение фарнезильной группировки - ядерные ламины А/B, белки Ras, а-фактор спаривания у дрожжей;
- присоединение геранил-геранильной группировки – γ-субъединицы у G-белков, некоторые белки (Rab) имеют две геранил-геранильных группы.
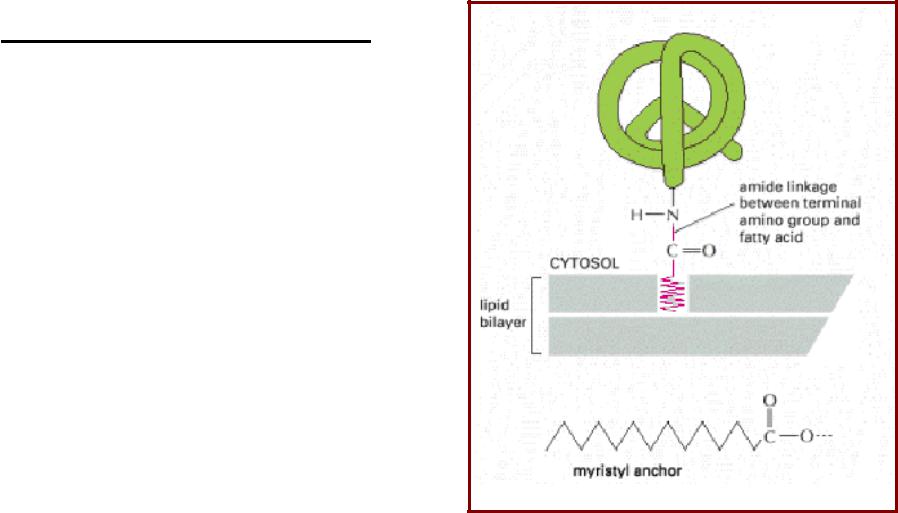
Липопротеины с N-концевой липидной группировкой. N-Миристоилирование
N-Миристоилирование
•Миристоилирование – котрасляционная модификация цитозольных белков, позволяет им присоединиться к мембране;
•Остаток миристиновой кислоты присоединяется всегда к аминогруппе N-концевого Gly;
•Характерно для многих сигнальных белков (протеинкиназа А (PKA); α- субъединицы некоторых G- белков).

Ограниченный протеолиз
Ограниченный протеолиз – процесс протеолитического
расщепления белков, который задерживается или
полностью останавливается на промежуточных продуктах.
• Продукты ограниченного протеолиза сохраняют компактность;
• Согласование «мотива», распознаваемого протеиназой, и
«шарнирной области» в белке-субстрате.
Большинство белков подвергаются ограниченному
протеолизу:
1. Отщепление N-концевого Met;
2. Отщепление сигнального пептида
Пребелки (preproteins) - белки, имеющие сигнальную |
|
|
последовательность; |
|
|
3. Активация неактивных предшественников (пробелков) |
|
|
Пробелки (proproteins) - неактивные белковые |
|
|
предшественники, активируемые ограниченным протеолизом; |
|
|
Препробелки (preproproteins) содержат сигнальную |
|
|
последовательность и требуют дальнейшего отщепления |
|
|
пропоследовательности для активации. |
6 |
|
4. Формирование белков неканонической структуры и др. |
||
|
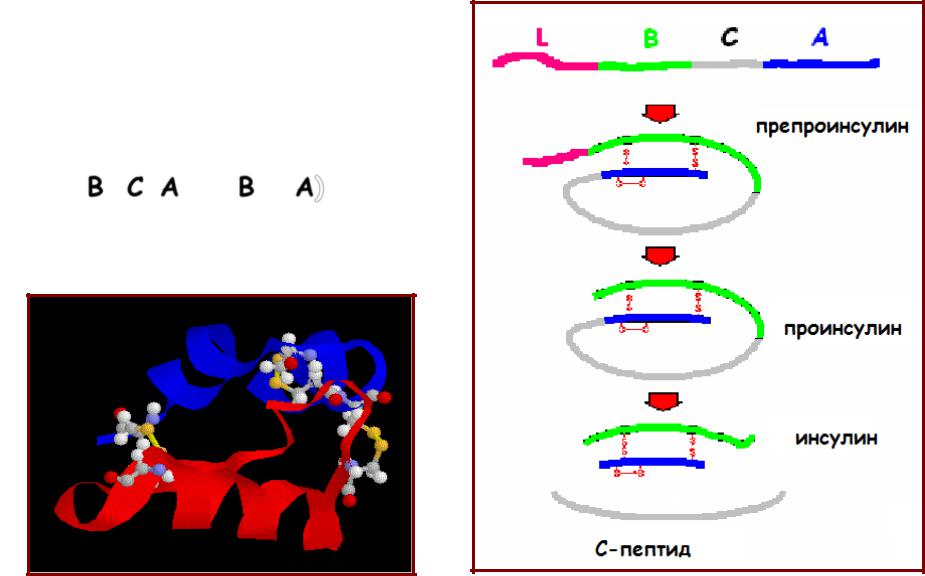
Формирование белка неканонической структуры. Инсулин
• Препроинсулин (110 ак) формирование S-S связей
отщепление лидерного пептида
•Проинсулин (86 ак)
вырезание С-пептида:
В–C-A (В + A)
•Инсулин – 21ак (А цепь) и
30ак (В цепь)
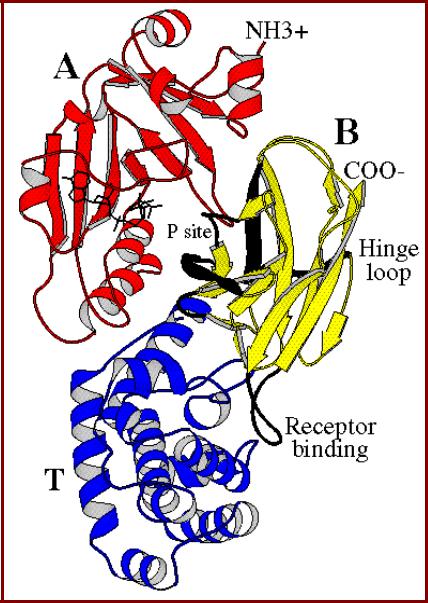
Разделение доменов. Дифтерийный токсин
• Дифтерийный токсин – продукт
Corynebacterium diphtheriae -
состоит из трех доменов:
–А -домен – каталитический домен;
–В-домен – рецепторсвязывающий домен;
–Т-домен – трансмембранный домен;
•Модифицирует фактор элонгации клеток эукариот - eEF-2 –
переносит АДФ-рибозный остаток NAD+ на дифтамид (модифицированный остаток гистидина);
• Катализируемая реакция
eEF-2 + NAD+
ADP-RIBOSE-DIPHTHAMIDE-eEF-2 + NICOTINAMIDE +H+
•Для ферментативной реакции необходимо отщепление домена А.
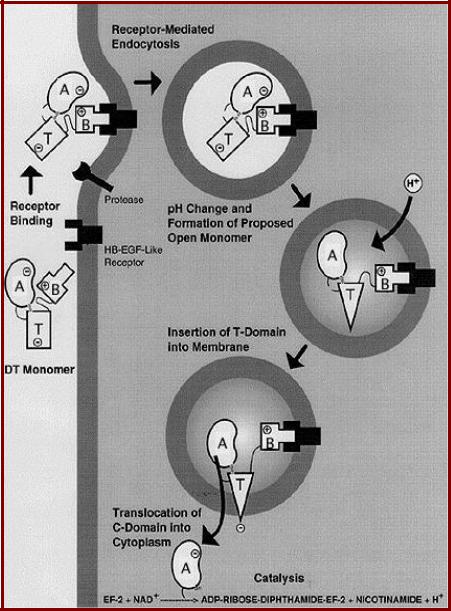
Механизм действия дифтерийного токсина
1.Связывание токсина с рецептором на клеточной поверхности;
2.Проникновение токсина в клетку с помощью рецепторопосредованного эндоцитоза; закисление среды в эндосомах;
3.Внедрение трансмембранного домена в мембрану эндосомы, протеолитическое отщепление каталитического домена и его проникновение в цитозоль;
4.АДФ-рибозилирование фактора элонгации eEF2 приводит к инактивации этого фактора и необратимому ингибированию синтеза белка. Это вызывает гибель клетки.
•Одной молекулы дифтерийного токсина достаточно для гибели клетки
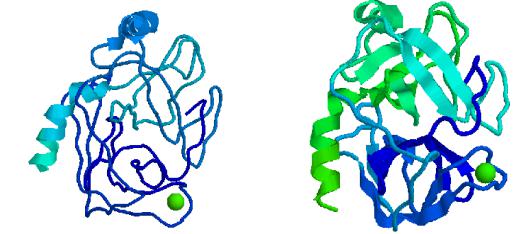
Активация предшественников ферментов
•Трипсиноген
Активационный пептид Трипсин
Val-Asp-Asp-Asp-Asp-Lys -|-Ile-Val-Gly-
Расщепление трипсином или энтеропептидазой
(в 1000 раз эффективнее)
Трипсиноген |
|
Трипсин |
|
|
|
|
|
|
•Многие ферменты синтезируются в виде неактивных предшественников
–проферментов или зимогенов;
•Во многих случаях активация
–протеолитическое отщепление активационного пептида (многие панкреатические сериновые протеиназы – например, трипсин);
•В пространственной структуре трипсина происходят незначительные изменения, но шире открывается реакционная полость – активируется фермент;
•Такая активация характерна и для многих факторов роста
(TGFbeta). 10
