
МОЛБИОЛ 2014-лекции / ОГК / Л4-Модификация-2-Сборка-1
.pdf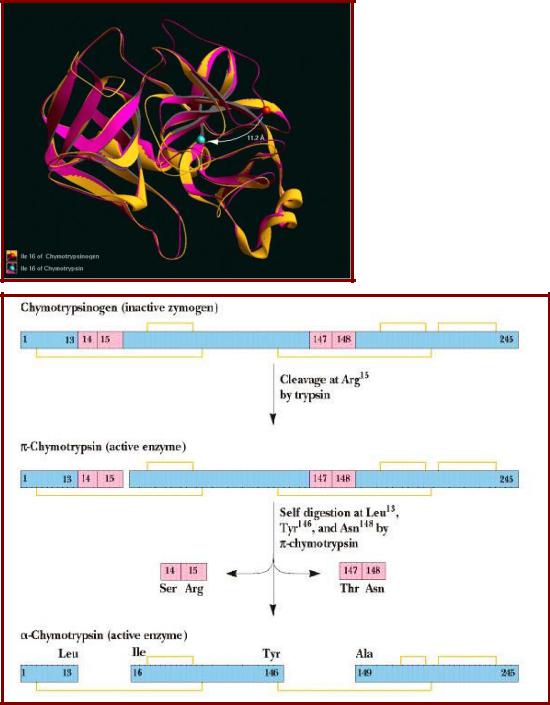
Положение Ile16 в химотрипсиногене (красный) химотрипсине (голубой)
Активация
химотрипсиногена
•Разрыв связи Arg15-Ile16,
пептид остается связанным с ферментом дисульфидной связью;
•Взаимодействие аминогруппы Ile16 с карбоксильной группой Asp184; происходят конформационные изменения в белке, приводящие к активации фермента (π-химотрипсин);
•Удаление дипептида
Ser14Arg15;
•Разрыв связи Asn148-Ala149;
• Удаление дипептида
Thr147Asn148 (α-химотрипсин). 11
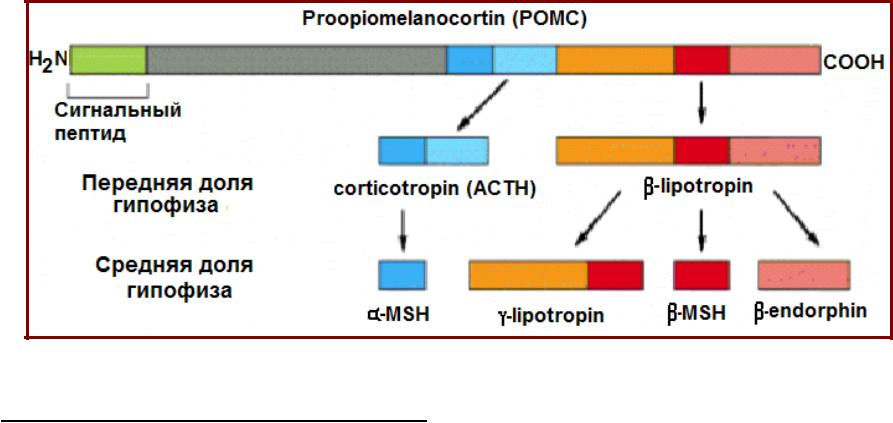
Протеолитический процессинг. Образование активных пептидов
• Проопиомеланокортин (POMC) – прогормон, состоящий из 241ак; |
|
• Гормонально активными являются продукты расщепления РОМС |
|
специфическими эндопептидазами; |
|
• В зависимости от места синтеза и конкретных стимулов образуются: |
|
- в передней доле при стимуляции кортикотропин-релизинг-гормоном – |
|
кортикотропин (ACTH) и бета-липотропный гормон (β-lipotropin); |
|
- в средней доле при стимуляции дофамином – α-меланоцит- |
|
стимулирующий гормон (α-MSH), γ-lipotropin и β-endorphin; |
|
• Продукты расщепления производятся в эквимолярных количествах и |
|
секретируются в кровь одновременно (по уровню β-липотропного |
12 |
гормона оценивают адренокортикотропную функцию гипофиза). |
|
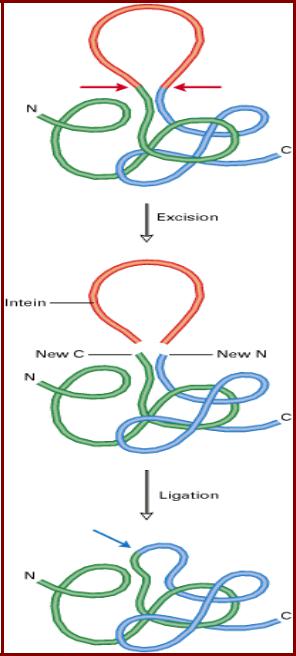
Сплайсинг белков
• Интеины (белковые интроны, intein – introne protein) – области белка, удаляемые посттрансляционно;
•Фланкирующие районы (экстеины - extein) – соединяются, образуя новый белок;
•Интеины в белках впервые обнаружены в 1987 году;
•Процесс аутокаталитический;
•Интеины – 134-608 ак остатков;
•Найдены у эубактерий, низших эукариот; больше всего – у архебактерий, не найдены у высших эукариот.
•Большинство интеинов состоят из двух доменов – один участвует в аутокаталитическом сплайсинге, другой – эндонуклеаза – может быть важен в распространении интеинов;
•Интеины найдены у белков с различными функциями (метаболические ферменты, протеазы, ДНК- и РНК-полимеразы, ферменты, участвующие в репликации и репарации ДНК, и
др.).
13
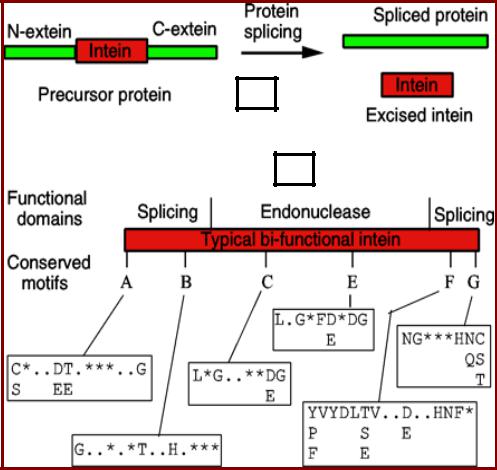
Структура интеина
1
2
* - гидрофобные ак – V,L,I,M;
. – неконсервативные замены.
1.Схема сплайсинга белка;
2.Структура интеина:
•Два терминальных района формируют домен сплайсинга типичного бифункционального интеина;
•Центральный домен – эндонуклеаза;
•Найдено шесть консервативных мотивов (A-G);
Последовательность интеина |
|
начинается и заканчивается |
|
определенными ак остатками |
|
мотивов А и G, соответственно; |
|
Мотивы С и Е – 9-членные |
|
мотивы, найденные в |
|
эндонуклеазах; |
|
• Встречаются миниинтеины |
|
(miniintein), в которых |
|
отсутствует эндонуклеазный |
|
домен. |
14 |
|
|
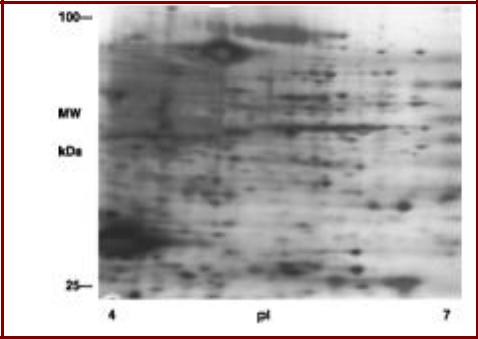
Идентификация посттрансляционных модификаций белков
•Методы протеомики –
-двумерный гель-электрофорез (распределение по молекулярной массе и изоэлектрической точке),
-масс-спектрометрия в комбинации с протеолитическим расщеплением и HPLC анализом;
•Введение радиоактивных меток в растущие клетки, хроматографическое выделение и анализ меченых белков;
•Использование антител (антитела к фосфотирозину)
2D-электрофорез гликозилированных ядерных и цитоплазматических
белков, выделенных из клеток HeLa с помощью O-GlcNAc-специфических антител
15
Пространственное сворачивание
или фолдинг белков I
16

Биогенез белков
•Биогенез белков означает «рождение» белков и переход между ненативным и нативным состоянием белка
•Биогенез включает в себя:
–синтез полипептидной цепи;
–химическую и структурную модификацию белков;
–пространственное сворачивание (фолдинг) белка
(folding);
–сборку белковых комплексов (assembly);
–транспорт белков к мембранам и транслокацию их через мембраны;
–вторичный фолдинг или «пересворачивание» белков (рефолдинг).
17

Сворачивание или фолдинг (от англ. folding) белка – это процесс, при котором белковая молекула принимает характерную для ее функционирования пространственную структуру, известную также как нативное состояние.
Денатурация белков — потеря белками их естественных свойств (растворимости, гидрофильности и др.) и, как следствие, их функциональной активности вследствие нарушения пространственной структуры их молекул. При денатурации происходит нарушение вторичной, третичной (и четвертичной) структуры белка. В некоторых случаях денатурация обратима.
Ренатурация белков — процесс, обратный денатурации, при котором белки возвращают свою природную структуру и функциональную активность.
Факторы, вызывающие денатурацию – рН, to, органические растворители,
соли и др.
Денатурация |
Ренатурация |
18 |
|
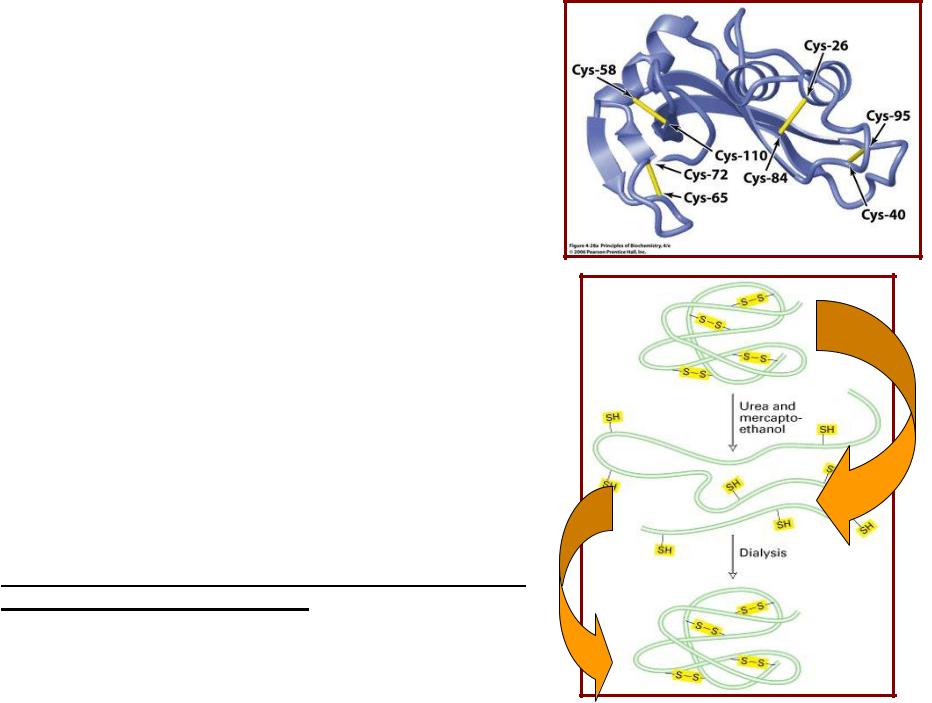
Роль первичной структуры в
пространственной сборке белка
Опыты Кристиана Анфинсена (C.Anfinsen) по восстановлению активности рибонуклеазы А (1957г.)
/Нобелевская премия по химии 1972г./
Обработка рибонуклеазы А мочевиной и 2- меркаптоэтанолом (2-МЭ) приводит к полной потере активности;
Удаление мочевины и 2-МЭ диализом при окислении кислородом приводит к полному восстановлению ферментативной активности белка;
Удаление 2-МЭ и окисление при мочевине, затем ее удаление приводит к восстановлению около 1% ферментативной активности;
Полное восстановление активности происходит при добавлении восстанавливающих агентов.
•Первичная последовательность определяет его третичную структуру;
•Восстановление третичной структуры белка (рибонуклеазы) происходит самопроизвольно;
•Не требуется дополнительной энергии.
денатурация
ренатурация
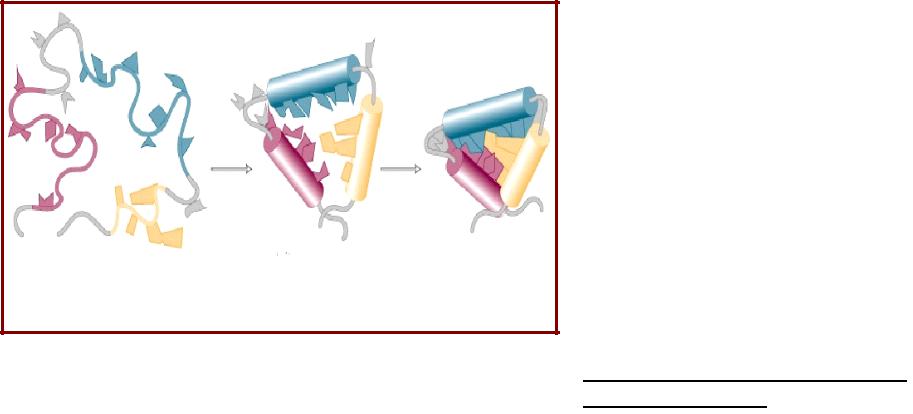
Стадии самопроизвольного сворачивания полипептидной цепи в нативную конформацию in vitro
«Расплавленная глобула»
Полипептидная цепь |
Нативный белок |
•Быстрое формирование элементов вторичной структуры;
•Ассоциация некоторых элементов вторичной структуры - образование супервторичной структуры;
•Формирование «расплавленной глобулы» (создание основных элементов третичной структуры - сочетание α- спиралей, β-тяжей, соединяющих петель и образование гидрофобного ядра молекулы);
•Формирование нативной структуры белка (самая длительная стадия). 20
