
МОЛБИОЛ 2014-лекции / ОГК / Л4-Модификация-2-Сборка-1
.pdf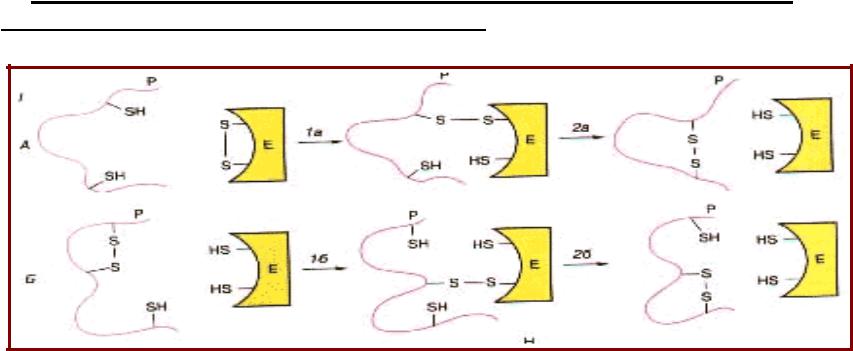
Ферменты, ускоряющие процесс сворачивания белков
(ферменты фолдинга, или фолдазы)
•Протеиндисульфидизомераза (PDI)
-катализирует образование и изомеризацию дисульфидных связей;
-локализуется в просвете ЭР и способствует сворачиванию секретируемых клетками белков, содержащих дисульфидные мостики (например, инсулин, рибонуклеаза, иммуноглобулины);
-связывается с частично развернутыми белками, близкими к состоянию «расплавленной глобулы»
Ферменты, ускоряющие процесс сворачивания белков
(ферменты фолдинга, или фолдазы)
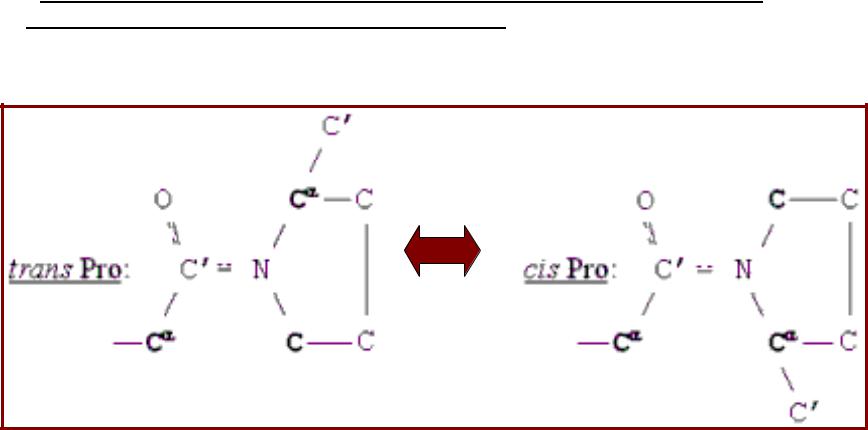
• Пептидил-пролил-цис/транс-изомераза (PPI)
катализирует переход радикалов в области пептидной связи пролина из транс-конфигурации в цис-конфигурацию и обратно
(связывается с частично развернутыми белками, близкими к состоянию «расплавленной глобулы»);
•В разных белках до 7% связей, образованных остатками пролина, изомеризуются в цис-конформацию.
Сборка белков in vivo происходит при других условиях, чем в экспериментах in vitro
In vivo:
1. Большая концентрация белков в клетке
(до 200-300 мг/мл);
2.Высокая температура
(370С);
3.Присутствие других макромолекул;
4.Физиологические условия (низкая ионная сила);
5.Сборка многих сложных белков и комплексов.
6.Существование мутантных форм E.Coli, при которых нарушается сборка многих белков.
In vitro:
1.Низкая концентрация белков в эксперименте (1 мкг/мл – 1 мг/мл);
2.Низкая температура
(~ 40С);
3.Отсутствие других макромолекул;
4.Часто нефизиологические условия (высокая ионная сила);
5.Изучение сборки в основном простых белков и комплексов.
23
Пространственное сворачивание белков in vivo осуществляется с помощью шаперонов
•Молекулярные шапероны
– большая группа неродственных белковых семейств, которые
–участвуют в стабилизации развернутых или частично свернутых белков;
–содействуют корректному фолдингу белков и сборке белковых комплексов.
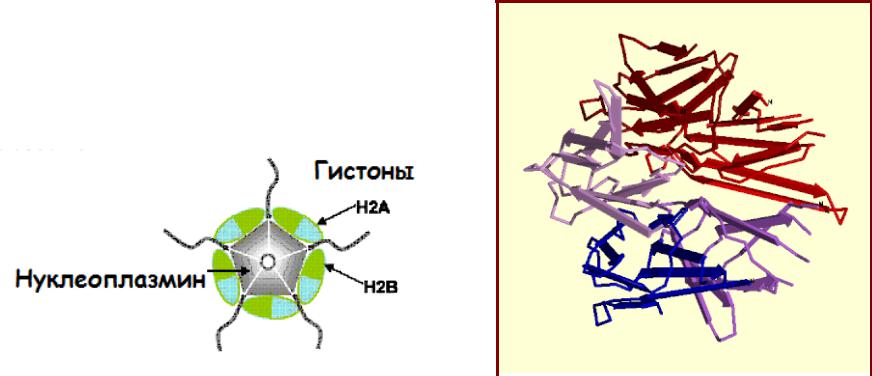
• Нуклеоплазмин –
первый «молекулярный шаперон» участвует в сборке нуклеосом (Ron Laskey et al., 1978).
|
|
|
|
|
|
|
|
|
|
Нуклеоплазмин в комплексе с гистонами |
Структура нуклеоплазмина 24 |
|||
|
(схема) |
(центральная часть молекулы) |
||
|
|
|
||

• Молекулярные шапероны – белки, которые сами или
вместе с кофакторами временно связываются и
стабилизируют нестабильные конформеры других
белков. Благодаря регулируемому связыванию и освобождению, шапероны содействуют правильному формированию и функционированию белков in vivo, а именно:
• фолдингу белков (после синтеза белков de novo, транслокации
через мембраны или стресс-индуцированной денатурации);
•сборке белковых комплексов;
•внутриклеточному транспорту;
•переключению между активной и неактивной конформациями белков;
•протеолитической деградации,
хотя они не входят в конечную структуру белков и белковых комплексов.
Т.о. именно этими белками осуществляется контроль качества (Quality control, QC) белков в клетке. 25
